Оригинальная статья
КИШЕЧНЫЕ ПРОТОЗООЗЫ




Например, Giardia lamblia может вызвать тяжелую острую диарею, которая может привести к хронической диарее и нарушениям питания;Многочисленные простейшие населяют желудочно-кишечный тракт человека (см. Вставку). В этот список входят представители многих разнообразных групп простейших. Большинство этих простейших не являются патогенными комменсалами или вызывают только легкое заболевание. Некоторые из этих организмов при определенных обстоятельствах могут вызывать тяжелые заболевания.
Entamoeba histolytica может стать очень вирулентным и инвазивным организмом, вызывающим потенциально смертельное системное заболевание. Виды
Apicomplexa и microsporidia
(обсуждаемые в другом месте), которые обычно не вызывают тяжелого заболевания, могут вызывать тяжелую и опасную для жизни диарею у больных СПИДом и других лиц с ослабленным иммунитетом.
Trichomonas vaginalis не находится в желудочно-кишечном тракте, но часто обсуждается с кишечными жгутиконосцами. Он поражает урогенитальный тракт и вызывает заболевание, передающееся половым путем .
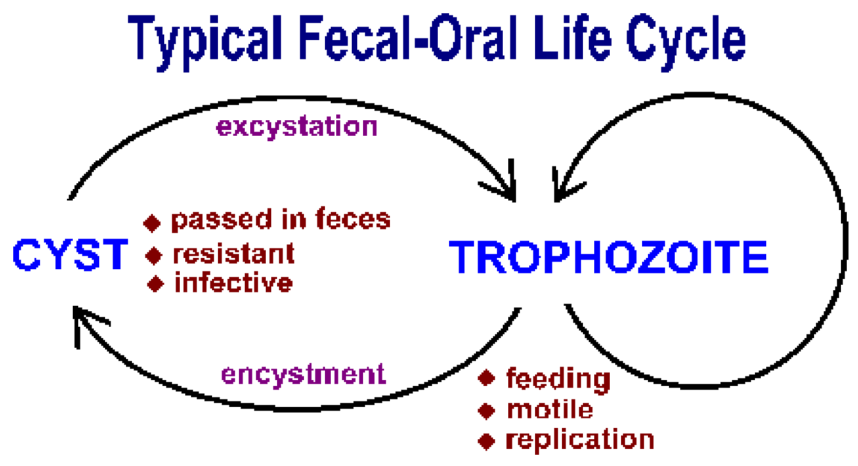
Кишечные простейшие передаются фекально-оральным путем и, как правило, имеют сходные жизненные циклы, состоящие из стадии цисты и стадии трофозоита (рисунок). Фекально-оральная передача предполагает прием пищи или воды, зараженной цистами. После проглатывания подходящим хозяином цисты превращаются в трофозоиты, которые демонстрируют активный метаболизм и обычно подвижны. Паразит поглощает питательные вещества и подвергается бесполому размножению во время трофической фазы. Некоторые трофозоиты вместо репликации развиваются в цисты. Цисты отличаются устойчивой стенкой и выводятся с калом. Стенка цисты защищает микроорганизм от высыхания во внешней среде, поскольку паразит переживает период относительного покоя, ожидая, пока его проглотит следующий хозяин. Факторы, повышающие вероятность проглатывания материала, загрязненного фекальными массами, играют определенную роль в передаче этих кишечных простейших (см. Вставку). В целом, передаче инфекции способствуют ситуации, связанные с тесным контактом человека с человеком и антисанитарные условия.
| Факторы фекально-оральной передачи |
плохая личная гигиена
развивающиеся страны
водные эпидемии
мужской гомосексуализм
зооноз?
|
ТЕМЫ :
- Лямблиоз
-
- Жизненный цикл и морфология
- Трофозоит
- Циста
- Клейкий диск
- Симптомы и патогенез
- Диагностика
- Лечение и контроль
- Жизненный цикл и морфология
- Трихомониаз
- Dientamoeba fragilis
- Балантидоз
- Амебиаз
- Blastocystis hominis
- Непатогенные комментарии
ГИАРДИАЗ (ЛЯМБЛИОЗ)
Лямблии (также известные как G. duodenalis , см. Комментарии к таксономии ) – простейшие паразиты, которые колонизируют верхние отделы тонкой кишки. Он имеет мировое распространение и является наиболее распространенным простейшим, выделяемым из стула человека. Заболеваемость оценивается в 200 миллионов клинических случаев в год. Фактически, это был, вероятно, первый когда-либо наблюдаемый симбиотический простейший. Вполне вероятно, что Ван Левенгук, изобретатель микроскопа, впервые описал лямблии в 1681 году на своем собственном стуле, основываясь на своем описании характерных движений лямблий . Однако ван Левенгук никогда не представлял рисунков организмов, и Ламблу обычно приписывают идентификацию лямблий в стуле педиатрических пациентов в Праке в 1859 году.
Обычно лямблии неинвазивны и часто приводят к бессимптомным инфекциям. Симптоматический лямблиоз характеризуется острой или хронической диареей и / или другими желудочно-кишечными проявлениями.
ЖИЗНЕННЫЙ ЦИКЛ И МОРФОЛОГИЯ
Лямблии демонстрируют типичный фекально-оральный цикл передачи ( см. Выше ). Инфекция передается при попадании цисты внутрь. Факторы, приводящие к загрязнению пищи или воды фекалиями, связаны с передачей инфекции (вставка). Например, лямблиоз особенно распространен у детей, особенно у детей, находящихся в детских учреждениях или детских садах. В развивающихся странах плохая санитария способствует более высокому уровню лямблиоза, также были зарегистрированы вспышки заболеваний, передающихся через воду из-за неадекватной очистки воды. Считается, что туристы в районах, где нет человеческого жилья, приобретают воду в результате питья из ручьев, и некоторые данные предполагают, что резервуаром являются бобры. Однако зоонозная передача лямблийя вляется спорной и однозначно не продемонстрирована. Неясно, представляет ли Giardia lamblia отдельный вид, способный инфицировать широкий круг животных, или у каждого хозяина есть свои собственные «домашние» лямблии . Свидетельства, указывающие на то, что передача лямблий от собак к человеку довольно редка, говорят в пользу последнего. Молекулярные данные свидетельствуют о том, что некоторые изоляты демонстрируют узкие диапазоны хозяев, тогда как другие демонстрируют широкие диапазоны хозяев (см. Примечания по таксономии ). Независимо от того, возможна ли зоонозная передача, передача от человека к человеку является наиболее распространенным способом передачи, а факторами риска являются тесный контакт с людьми в сочетании с антисанитарными условиями.
Проглоченная циста проходит через желудок, а эксцистация происходит в двенадцатиперстной кишке. Эксцистацию можно вызвать in vitro кратковременным воздействием на цисты кислого pH (~ 2) или других источников ионов водорода. Такое воздействие кислого pH имитирует состояние желудка и, вероятно, действует как экологический сигнал для паразита. Активность жгутиков начинается в течение 5-10 минут после обработки кислотой, и трофозоит выходит через разрыв в стенке цисты. Считается, что разрушение стенки цисты опосредуется протеазами. Трофозоит подвергнется цитокинезу (делению клетки без репликации ядер) в течение 30 минут после выхода из цисты, что приведет к образованию двух биядерных трофозоитов.
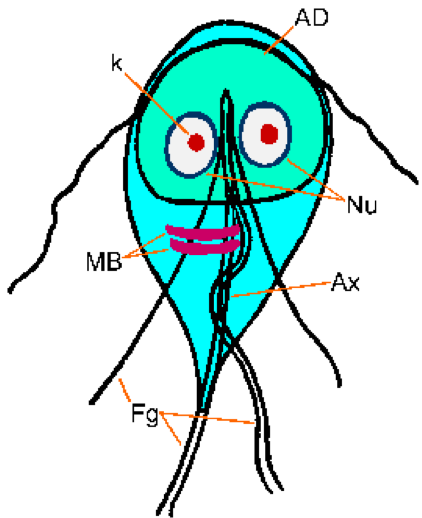 Giardia трофозоита при взгляде сверху имеет характерную грушевидную или каплевидную форму с двусторонней симметрией (рисунок). Обычно он составляет 12-15 м в длину, 5-10 м в ширину и 2-4 м в толщину. Характерные черты окрашенного трофозоита включают: два ядра (Nu) с центральными кариосомами (k), фибриллы, проходящие по длине паразита, и срединные тела (MB). Большая кариосома и отсутствие периферического хроматина придают ядрам вид ореола. Фибриллы называются аксонемами (Ax) и образуются из проксимальных областей жгутиков (Fg) внутри тела трофозоита. Срединные тела представляют собой пару изогнутых стержневидных структур, расположенных кзади от ядер. На ультраструктурном уровне срединные тела содержат множество микротрубочек. Функция срединных тел неизвестна,но большинство полагает, что они каким-то образом связаны с липким диском и его образованием.
Giardia трофозоита при взгляде сверху имеет характерную грушевидную или каплевидную форму с двусторонней симметрией (рисунок). Обычно он составляет 12-15 м в длину, 5-10 м в ширину и 2-4 м в толщину. Характерные черты окрашенного трофозоита включают: два ядра (Nu) с центральными кариосомами (k), фибриллы, проходящие по длине паразита, и срединные тела (MB). Большая кариосома и отсутствие периферического хроматина придают ядрам вид ореола. Фибриллы называются аксонемами (Ax) и образуются из проксимальных областей жгутиков (Fg) внутри тела трофозоита. Срединные тела представляют собой пару изогнутых стержневидных структур, расположенных кзади от ядер. На ультраструктурном уровне срединные тела содержат множество микротрубочек. Функция срединных тел неизвестна,но большинство полагает, что они каким-то образом связаны с липким диском и его образованием. 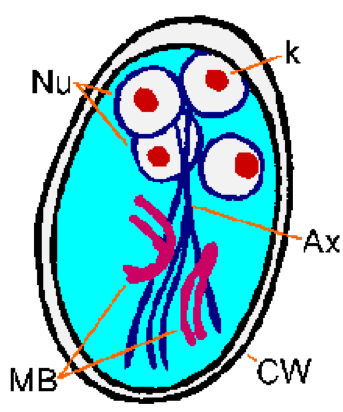 Адгезивный диск (AD), не всегда видимый при световой микроскопии, занимает вентральную сторону переднего конца.
Адгезивный диск (AD), не всегда видимый при световой микроскопии, занимает вентральную сторону переднего конца.
Трофозоиты лямблий обладают четырьмя парами жгутиков и подвижны. Три пары жгутиков выходят из дорсальной поверхности (передняя, заднебоковая, каудальная) и одна пара выходит из вентральной поверхности. Трофозоиты демонстрируют характерное беспорядочное вращательное движение, иногда сравнимую с падающим листом. Однако трофозоиты преимущественно обнаруживаются прикрепленными к эпителиальным клеткам тонкой кишки (особенно двенадцатиперстной кишки и тощей кишки) и редко обнаруживаются в стуле, за исключением случаев тяжелой диареи. Это прикрепление к кишечному эпителию опосредуется органеллой на вентральной стороне паразита, называемой адгезивным диском ( см. Ниже). Трофозоит поглощает питательные вещества из просвета кишечника посредством пиноцитоза, и еще не было описано никаких специализированных питательных органелл.
Трофическая стадия также характеризуется бесполым воспроизведением. Оба ядра делятся примерно в одно и то же время, и цитокинез восстанавливает двухъядерное состояние. Каждая дочерняя клетка получает по одной копии каждого ядра. Оба ядра кажутся равными в отношении экспрессии генов и других свойств.
В качестве альтернативы репликации трофозоит может энцистировать. Во время инцистирования паразит собирается, отделяется от кишечного эпителия и выделяет стенку цисты. Энцистацию также можно проводить in vitro. Оптимальная индукция инцистментации достигается путем лишения трофозоитов желчи при pH 7 с последующим воздействием высоких концентраций желчи при pH 7,8. Отсутствие желчи при нейтральном pH имитирует условия в слизистой оболочке, прилегающей к эпителиальным клеткам кишечника, тогда как воздействие высоких концентраций желчи при более щелочном pH аналогично просвету кишечника. Эти исследования подчеркивают степень адаптации лямблий к жизни в желудочно- кишечном тракте.
Молекулярные и ультраструктурные исследования показывают синтез белков стенки цисты и появление больших секреторных пузырьков в цитоплазме паразита после индукции энцистмента. После образования стенки цисты паразит проходит один раунд деления ядра без цитокинеза, в результате чего образуются четыре ядра. Эти четыре ядра (Nu) обычно расположены на переднем конце цисты (рисунок). Жгутики и адгезивный диск утрачиваются по мере созревания цисты, но аксонемы (Ax) и срединные тела (MB) сохраняются. Отличительные фибриллы (т.е. аксонемы), которые проходят по длине цисты, приводят к тому, что лямблии относительно легко однозначно идентифицировать. цисты имеют овальную форму и типичные размеры 11-14 мкм в длину и 6-10 мкм в ширину. Другие характеристики цисты лямблий включают хорошо выраженную стенку (CW), которая часто отделена от цитоплазмы паразита. Цисты выводятся с фекалиями и могут сохраняться до трех месяцев при соответствующих условиях температуры и влажности. Зрелые цисты заразны для следующего хозяина, который их проглотит, завершая, таким образом, жизненный цикл.
КЛЕЙКИЙ ДИСК
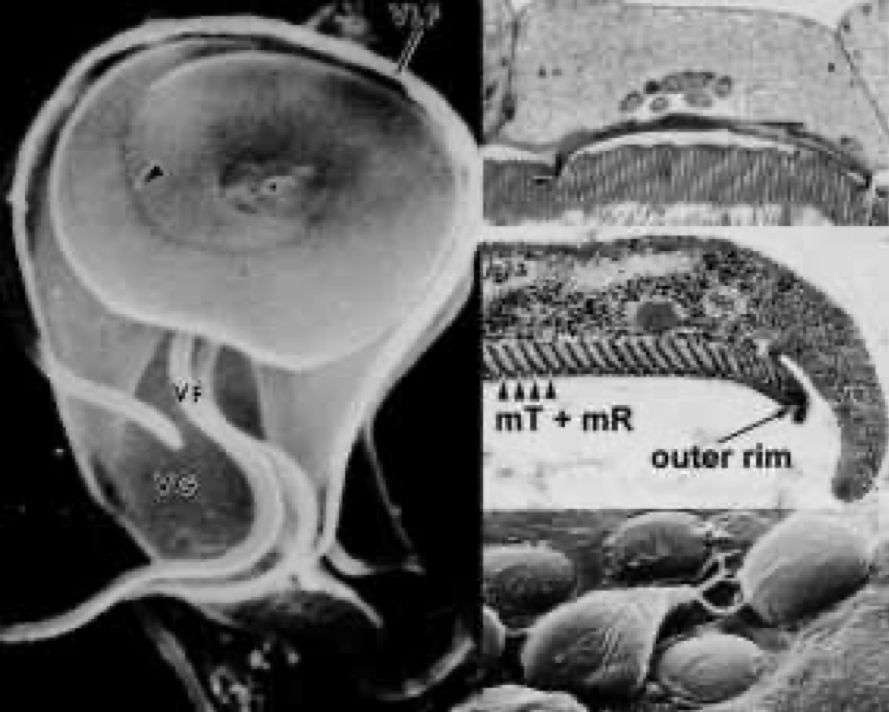
Уникальной ультраструктурной особенностью лямблий является липкий диск (также называемый вентральным диском, сосательным диском, присоской или полосатым диском). Адгезивный диск представляет собой вогнутую структуру, которая занимает примерно две трети переднего конца брюшной поверхности (рисунок, левая панель). Как следует из названий, эта структура играет роль в прикреплении трофозоитов к кишечному эпителию, а ультраструктурные исследования выявляют тесные ассоциации между адгезивным диском и щеточной каймой кишечника (рисунок, верхняя правая панель). Клейкий диск представляет собой относительно жесткую структуру, и с помощью просвечивающей электронной микроскопии видны полосы. Эти полосы являются результатом микротрубочек (mT) и уникального цитоскелетного элемента, называемого микроленточками (mR). Микроленточки представляют собой длинные сплюснутые структуры, каждая из которых связана с микротрубочкой (рисунок, средняя правая панель). Комбинированная структура микротрубочки- микроленточки расположена концентрическими рядами, которые образуют плоскую спираль с минимальным перекрытием. Внешний край адгезивного диска, называемый боковым гребнем, содержит компоненты актин-миозинового цитоскелета.
Основным компонентом микрофибры являются белки, которые называются лямблиями (также называемыми бета-лямблиями). Эти лямблии играют в первую очередь структурную роль в образовании микро ленточек. Интересно, что лямблины демонстрируют ограниченную гомологию с белком, называемым «сборка поперечно- полосатых волокон» из Chlamydomonas (свободноживущих, двухжгутиковых одноклеточных водорослей). У хламидомонады этот белок образует нитевидные структуры у основания жгутиков. Лямблики эволюционировали, чтобы играть иную функциональную роль в лямблиях , но все еще связаны с элементами цитоскелета, основанными на микротрубочках.
Эта ассоциация белков, участвующих в генерации сократительной силы и других цитоскелетных элементов в адгезивном диске, предполагает, что прикрепление опосредуется механическими силами, создаваемыми паразитом. Наблюдение, что отпечатки и круглые куполообразные поражения остаются на щеточной границе кишечника (т.е. микроворсинки) после отслоения трофозоитов (рисунок, нижняя правая панель), согласуется с сократительными силами, играющими роль в прикреплении. Другие предлагаемые механизмы прикрепления лямблий к кишечному эпителию включают гидродинамические силы, создаваемые вентральными жгутиками, и рецептор-опосредованное связывание через лектины на поверхности трофозоитов. Однако движение жгутиков плохо коррелирует с прикреплением, и поверхностные лектины покрывают весь трофозоит и не локализуются конкретно на липком диске.
СИМПТОМЫ И ПАТОГЕНЕЗ
Клинические признаки, связанные с инфекцией Giardia, варьируются от полного латентного периода (т. е. бессимптомно) до острой саморазрешающейся диареи и хронических синдромов, связанных с нарушениями питания, потерей веса и задержкой развития. У детей клинические симптомы проявляются чаще, чем у взрослых, и последующие инфекции, как правило, менее серьезны, чем первоначальные инфекции. Инкубационный период обычно составляет 1-2 недели, но сообщается о диапазоне от 1 до 75 дней.
Нажмите, чтобы увеличить изображение
Первые признаки острого лямблиоза включают тошноту, потерю аппетита и беспокойство в верхних отделах желудочно-кишечного тракта. Эти признаки часто сопровождаются или сопровождаются внезапным появлением взрывной, водянистой диареи с неприятным запахом. Выделения, связанные с инфекциями от лямблий обычно описываются как субстанция рыхлая, объемная, пенистая и / или жирная с отсутствием крови или слизи, что может помочь отличить лямблиоз от других острых поносов. Другие желудочно-кишечные расстройства, связанные с лямблиозом, включают: метеоризм, вздутие живота, анорексию, судороги и гнилостную серную отрыжку (иногда называемую «пурпурными отрыжками»). Острая стадия обычно проходит спонтанно через 3-4 дня и часто не распознается как лямблиоз. Однако иногда острая инфекция сохраняется и приводит к мальабсорбции, стеатореи (чрезмерная потеря жира с калом), слабости (потере силы) и потере веса. Некоторые люди, у которых устранены острые симптомы, не избавляются от инфекции, но становятся бессимптомными носителями цисты без клинических проявлений. Тогда как другие могут иметь несколько спорадических рецидивов острых симптомов.
Острые инфекции также могут перерасти в длительные подострые или хронические инфекции, которые в редких случаях длятся годами. У типичного пациента с хронической стадией возникают повторяющиеся кратковременные эпизоды жидкого гнилостного стула, который может быть желтоватым, пенистым и плавучим, сопровождающимся кишечным бульканьем, вздутием живота и метеоризмом. Между эпизодами стул обычно мягкий, но также может наблюдаться нормальный стул или запор. Судороги нечасты при хронических инфекциях, но серная отрыжка бывает частой. Анорексия, тошнота и беспокойство в эпигастрии – дополнительные частые жалобы при хронических инфекциях. В большинстве хронических случаев паразиты и симптомы исчезают самопроизвольно.
Пост- Лямблиозная непереносимость лактозы .
Некоторые пациенты могут иметь непереносимость лактозы во время активной инфекции Giardia, которая может сохраняться после избавления от паразитов. Это клиническое проявление связано с вызванной паразитами лактазной недостаточностью и наиболее часто встречается у этнических групп с предрасположенностью к лактазной недостаточности. Лактаза – это фермент, расщепляющий лактозу, сахар, содержащийся в молоке, до моносахаридов, которые могут усваиваться. Этот синдром непереносимости лактозы следует учитывать у людей, у которых после лечения все еще присутствует кашицеобразный стул и чрезмерное газообразование, но нет обнаруживаемых паразитов.Специфические механизмы патогенеза лямблий, приводящие к диарее и кишечной мальабсорбции, до конца не изучены, и специфические факторы вирулентности не идентифицированы. Прикрепление трофозоитов к краю цисти может вызвать механическое раздражение или повреждение слизистой оболочки. Кроме того, у некоторых пациентов нарушается нормальная структура ворсинок. Например, притупление ворсинок (атрофия) и гипертрофия клеток крипт, а также увеличение глубины крипт наблюдаются в разной степени. Увеличение количества клеток крипт приведет к репопуляции кишечного эпителия относительно незрелыми энтероцитами со сниженной абсорбционной способностью. Также наблюдалась повышенная инфильтрация воспалительных клеток в собственной пластинке, и это воспаление может быть связано с патологией. Лямблиозная инфекция также может привести к дефициту лактазы (см. непереносимость лактозы ниже), а также к дефициту других ферментов в микроворсинках. Это снижение переваривания и всасывания растворенных веществ может привести к осмотической диарее и также может объяснить синдромы мальабсорбции. До сих пор ни один фактор вирулентности или объединяющий механизм не объясняют патогенез лямблиоза. [См. Также общее обсуждение диареи в Патофизиологии диареи.]
ДИАГНОСТИКА
| Обнаружение паразитов |
Обследование стула
Дуоденальный аспират или биопсия
|
Диагноз подтверждается обнаружением цист или трофозоитов в кале или в дуоденоеюнальном аспирате или биопсии. Обнаружение паразитов может быть затруднено, поскольку лямблии не всегда появляются в кале у всех пациентов. У некоторых пациентов наблюдается высокий уровень цист почти во всем стуле, тогда как у других наблюдается лишь небольшое количество паразитов в некоторых стулах. Также наблюдалась смешанная картина, при которой периоды высокой экскреции цисты чередуются с периодами низкой экскреции. Кроме того, паразитов легче обнаружить при острых инфекциях, чем при хронических. Аспирация и биопсия также могут не подтвердить инфекцию из-за очагов инфекции, и некоторые ставят под сомнение полезность этих инвазивных процедур.
Исследование кала является предпочтительным методом диагностики лямблий . Следует исследовать три стула, взятые с интервалом не менее двух дней. Водянистый или жидкий стул может содержать подвижные трофозоиты, которые можно обнаружить при немедленном исследовании влажных мазков. В противном случае образец следует законсервировать и окрасить из-за лабильности трофозоитов. Более стойкие цисты относительно легко распознать как в прямых, так и в окрашенных мазках ( см. Морфологию цисты ). Кроме того, доступны диагностические наборы, основанные на иммунофлуоресценции или обнаружении копроантигенов.
Диагноз также можно поставить, исследуя дуоденальную жидкость на наличие трофозоитов. Дуоденальную жидкость получают либо путем интубации, либо с помощью Enterotest® (также называемого «струнным тестом»). Энтеротест® состоит из желатиновой капсулы, содержащей нейлоновую нить соответствующей длины. Свободный конец шнура прикрепляется к лицу пациента, и капсула проглатывается. Через четыре часа до ночи струна извлекается, слизь, окрашенная желчью, с дистальной части струны соскабливается и исследуется как с помощью влажного крепления, так и с помощью постоянного окрашивания. Биопсия тонкого кишечника, предпочтительно из нескольких участков двенадцатиперстной кишки и тощей кишки, также может выявить трофозоиты, прикрепленные к кишечному эпителию. [Тонкая кишка делится на 3 отдела: двенадцатиперстная кишка (первая или проксимальная часть после желудка); тощая кишка (средняя часть);и подвздошная кишка (дистальная или последняя часть перед толстой кишкой).
ЛЕЧЕНИЕ И КОНТРОЛЬ
Инфицированных людей следует лечить, поскольку лямблии могут сохраняться и приводить к тяжелым синдромам мальабсорбции и потере веса. Лечение эффективно снижает заболеваемость и не имеет последствий. Метронидазол (Flagyl®), хотя и не лицензирован в США для лечения лямблиоза, эффективно избавляет от паразитов (уровень излечения примерно 85%) и является препаратом выбора. Рекомендуемая дозировка составляет 750 мг три раза в день в течение пяти дней (или, по крайней мере,> 3 дней). Детям рекомендуется 15 мг / кг / сут в три приема. Другие эффективные препараты включают: хинакрин (Атабрин®), тинидазол (Fasigyn®), фуразолидон (Furoxone®) и парамомицин (Humatin®). Тинидазол эффективен при однократном приеме двух граммов; парамомицин не всасывается и может быть полезен во время беременности.
Широкое распространение лямблий и инфекционность цист делают маловероятным, что человеческая инфекция будет полностью устранена. Меры контроля по предотвращению или уменьшению заражения лямблиями будут зависеть от конкретных обстоятельств передачи, но в целом включают меры, предотвращающие попадание в организм веществ, загрязненных фекальным материалом (см. Факторы фекально-оральной передачи.). Пропаганда здоровья и просвещение, направленные на улучшение личной гигиены, с упором на мытье рук, санитарию и обращение с пищевыми продуктами, являются эффективными мерами контроля для сокращения передачи инфекции от человека к человеку. Особое внимание следует уделять личной гигиене в ситуациях повышенного риска, например, в детских садах и других учреждениях. Лечение бессимптомных членов семьи предотвращает повторное заражение в неэндемичных районах. Однако ценность лечения бессимптомных носителей в гиперэндемичных сообществах сомнительна, поскольку частота повторного заражения высока. Социально-экономическая ситуация во многих развивающихся странах затрудняет профилактику инфекции. Для предотвращения эпидемий и снижения эндемичности требуются меры общественного здравоохранения для защиты источников воды от загрязнения.Туристы не должны пить водопроводную воду без дополнительной обработки в местах, где чистота сомнительна. Кипячение или обработка йодом убивает Цисты лямблий , но стандартное хлорирование – нет. Безопасных или эффективных химиопрофилактических препаратов от лямблиоза не существует.
ТРИХОМОНИАЗ
- Морфология и виды трихомонад
- Коробка передач и жизненный цикл
- Симптомы и патогенез
- Диагностика, лечение и контроль
Трихомонады – это группа жгутиковых простейших. Большинство представителей этой группы паразитируют, и идентифицировано лишь несколько свободноживущих видов. Как правило, трихомонады являются непатогенными комменсалами, и лишь несколько видов имеют значение для животных и людей. Четыре вида трихомонад заражают человека (таблица). Среди них только Trichomonas vaginalis является явно патогенным и обычно имеет низкую вирулентность. Остальные проявляют сомнительную патогенность.
|
Трихомонады человека |
||||||||||
|
Трихомонады человека населяют разные анатомические области.
T. vaginalis – распространенное заболевание, передающееся половым путем, в мочеполовых путях. T. tenax, также называемый T. buccalis, является комменсалом ротовой полости человека, особенно у пациентов с плохой гигиеной полости рта и прогрессирующим заболеванием пародонта. T. tenax или организм с аналогичной морфологией также иногда обнаруживается в легких. Такие случаи регистрировались в основном у пациентов с предшествующим раком или другими заболеваниями легких или после хирургического вмешательства. Pentatrichomonas hominis, ранее известная как Trichomonas hominis, является непатогенным комменсалом толстой кишки (см. Непатогенные кишечные жгутики). Некоторые авторы разделяют трихомонад на три рода по количеству свободных жгутиков. Виды с тремя жгутиками называются Tritrichomonas , с четырьмя – трихомонадами , а Pentatrichomonas – трихомонады с пятью свободными передними жгутиками. Первоначально считалось, что Dientamoeba fragilis является амебой (см. Непатогенную кишечную амебу ). Теперь известно, что это жгутиковый – но без жгутиков – родственник трихомонад.
Отличительной чертой трихомонад является аксостиль (топор), который проходит по всей длине организма и, кажется, выступает из заднего конца (рисунок). Аксостиль – это цитоскелетный элемент, состоящий из концентрических рядов микротрубочек, который, как полагают, выполняет функцию прикрепления паразита к эпителиальным клеткам. Для трихомонад также характерно наличие 4-6 жгутиков (fg), выходящих из переднего конца. Один из жгутиков прикреплен к телу организма и образует направленную назад волнообразную мембрану (um), тогда как остальные жгутики свободны. Комбинированные базальные тельца (bb) и основание волнообразной мембраны, называемые костой (cs), часто видны в окрашенных препаратах. Реже видна цитоостомальная борозда (cy). Единственное ядро (nu) находится на переднем конце паразита.
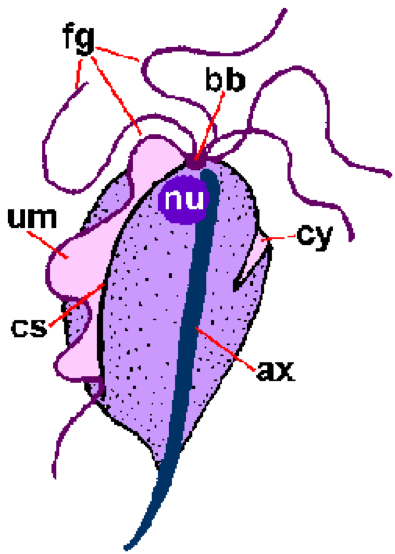
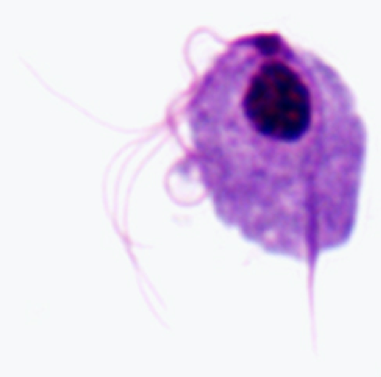

Схематическое изображение основных структурных особенностей трихомонад (слева). Окрашенный по Гимзе трофозоит T. vaginalis из культуры in vitro (в центре). Электронная микрофотография поперечного сечения аксостиля, показывающая концентрические ряды микротрубочек (справа).
Трихомонады, как и многие другие кишечные простейшие, обладают анэробным метаболизмом и лишены митохондрий. В энергетическом обмене трихомонад участвует уникальная органелла, называемая гидрогеносомой. Гидрогеносома имеет двойную мембрану и удаленно связана с митохондрией. Однако в нем отсутствуют ДНК, цитохромы и многие типичные митохондриальные функции, такие как ферменты цикла трикарбоновых кислот и окислительное фосфорилирование. Основная функция гидрогеносомы – это метаболизм пирувата, образующегося во время гликолиза в цитозоле, до ацетата и диоксида углерода с сопутствующим образованием АТФ. Электроны, выделяемые при окислении пирувата, передаются ионам водорода с образованием молекулярного водорода, отсюда и название гидрогеносома.
TRICHOMONAS VAGINALIS
Trichomonas vaginalis была впервые описана из гнойных выделений из влагалища в 1836 году и к началу двадцатого века была признана этиологическим агентом вагинита. Трихомониаз – распространенное заболевание, передаваемое половым путем, распространенное во всем мире, и, по оценкам, ежегодно во всем мире инфицируются 167 миллионов человек, а в Соединенных Штатах – 5 миллионов новых случаев инфицирования в год. Считается, что трихомониаз является наиболее распространенным невирусным заболеванием, передающимся половым путем. Несмотря на частоту трихомониаза, в прошлом он считался скорее неприятным паразитом, чем основным возбудителем. Однако сейчас это признано фактором, способствующим распространению ВИЧ-инфекции (см. Вставку), вызывающим маловесные и преждевременные роды и предрасполагающим женщин к значительному дискомфорту и стрессу.
|
Трихомонада и ВИЧ |
Патология, вызванная трихомонадой, может повысить эффективность передачи ВИЧ (1). Инфекция T. vaginalis обычно вызывает местный клеточный иммунный ответ с воспалением вагинального эпителия и шейки матки у женщин и уретры у мужчин. Этот воспалительный ответ включает инфильтрацию потенциальных клеток-мишеней ВИЧ, таких как лимфоциты и макрофаги, несущие CD4 +. Кроме того, T. vaginalisможет вызвать точечные кровоизлияния на стенках влагалища и шейке матки. Эта лейкоцитарная инфильтрация и поражения половых органов могут увеличить количество клеток-мишеней для вируса и обеспечить прямой доступ вируса к кровотоку через открытые поражения. Кроме того, кровоизлияния и воспаление могут увеличивать уровень вируса в жидкостях организма и количество ВИЧ-инфицированных лимфоцитов и макрофагов, присутствующих в области гениталий, у людей, уже инфицированных ВИЧ. Такое увеличение количества свободных вирусов и лейкоцитов, инфицированных вирусом, может увеличить вероятность контакта с ВИЧ и передачи неинфицированному партнеру. Было показано, что повышенное выделение ВИЧ из шейки матки связано с воспалением шейки матки, а у мужчин с трихомониазом зарегистрировано значительное увеличение вирусной нагрузки в сперме. Более того, поскольку у многих пациентов с инфекцией трихомонадой заболевание протекает бессимптомно или имеет незначительные симптомы, они, вероятно, сохранят половую жизнь, несмотря на инфекцию.
|
T. vaginalis, несмотря на свое название, поражает как мужчин, так и женщин. У женщин этот организм в основном обитает во влагалище, а у мужчин он обычно находится в уретре, предстательной железе или придатке яичка. Жизненный цикл состоит только из стадии трофозоитов, которая передается при прямом контакте во время полового акта. Невенерическая передача редка, но возможна, поскольку трофозоиты могут выжить 1-2 дня в моче и 2-3 часа на влажной губке. Кроме того, новорожденные были инфицированы во время родов. Трофозоиты живут тесно связанными или прикрепленными к эпителию урогенитального тракта, где они реплицируются путем бинарного деления.
СИМПТОМЫ И ПАТОГЕНЕЗ
|
Клинические проявления |
|
| Самки | Самцы |
|
|
| *% зараженных; **% симптоматических | |
T. vaginalisвызывает различные клинические проявления у мужчин и женщин, а у женщин (таблица) чаще проявляются симптомы, которые имеют тенденцию сохраняться дольше. Инкубационный период обычно составляет от 4 до 28 дней. У женщин инфекция может проявляться в виде легкого вагинита, острого или хронического вульвовагинита или уретрита. Начало или обострение симптомов обычно происходит во время или сразу после менструации. Наиболее частая жалоба, связанная с T. vaginalis инфекцией – это стойкий легкий вагинит, связанный с обильными выделениями с неприятным запахом, которые часто сопровождаются жжением или зудом. Эти выделения чаще всего серые, но могут быть желтыми или зелеными, иногда с пенистыми или кровянистыми выделениями. Выделения уменьшаются по мере того, как инфекция приобретает хронический характер. Многие женщины также испытывают болезненный или тяжелый половой акт. Поражение уретры происходит в большом количестве случаев и характеризуется дизурией (болезненным мочеиспусканием) и частым мочеиспусканием.
Эпителий влагалища является первичным очагом инфекции. Таким образом, стенки влагалища обычно эритематозные (т. Е. Красные) и могут показывать петехиальные (небольшие не выступающие пятна) кровоизлияния. Точечные кровоизлияния в шейку матки, называемые земляничной шейкой матки, наблюдаются примерно в 2% случаев. Эта клубничная шейка матки представляет собой характерное патологическое наблюдение, связанное с трихомонозом, которое не наблюдается при других заболеваниях, передающихся половым путем.
У мужчин, вероятно, протекает бессимптомно (50-90%), и инфекция, как правило, проходит самостоятельно. Уретра и простата – наиболее частые очаги инфекции. Общие симптомы включают: выделения из уретры (от скудных до гнойных), дизурию и зуд уретры. Некоторые мужчины испытывают жжение сразу после коитуса.
Мало что известно о патофизиологии, связанной с инфекцией T. vaginalis , но, предположительно, это связано с взаимодействием между паразитом и эпителиальными клетками хозяина. Исследования in vitro показывают, что T. vaginalis может разрушать клетки контактно-зависимым образом. Поэтому считается, что адгезия трофозоитов к эпителию является основным фактором патогенеза. Несколько белков адгезии были идентифицированы на поверхности трофозоитов. Кроме того, были идентифицированы секретируемые протеазы, которые могут играть роль в патогенезе.
ДИАГНОСТИКА, ЛЕЧЕНИЕ И КОНТРОЛЬ
В целом, клинические проявления не являются надежным средством диагностики, поскольку клинические проявления аналогичны другим проявлениям, и у многих пациентов симптомы легкие или отсутствуют. Диагноз подтверждается обнаружением трофозоитов во влагалище, уретре, секрете простаты или осадке мочи (после массажа простаты). Наиболее практичным методом диагностики является микроскопическое исследование влажных масс свежих выделений из влагалища, предпочтительно собранных с помощью зеркала на аппликаторе с ватным наконечником. Образцы следует разбавить физиологическим раствором и немедленно исследовать. T. vaginalis распознается по характерным морфологическим признакам ( см. Выше) и его быстрая судорожная моторика. Образцы также можно фиксировать и окрашивать красителями Гимза или флуоресцентными красителями. Однако на окрашенных предметных стеклах микроорганизмы может быть трудно распознать.
Чувствительность прямого наблюдения составляет 40-80%. Таким образом, культивирование in vitro считается золотым стандартом диагностики, несмотря на некоторые ограничения. Например, необходим доступ к помещениям, а организмам требуется 2-7 дней роста, прежде чем они будут обнаружены. Проблема доступности частично решена системой культивирования ТВ InPouch ™ (Biomed Diagnostics). Это коммерчески доступная автономная система для обнаружения T. vaginalis в клинических образцах. Разрабатываются тесты на основе антител и ДНК с высокой чувствительностью и специфичностью.
Метронидазол (Flagyl®) и другие нитроимидазолы, такие как тинидазол, очень эффективны против трихомониаза. Метронидазол активируется гидрогенсомом до промежуточного нитро-радикального иона. Можно использовать либо однократную дозу в два грамма (показатель излечения 85-92%), либо 250 мг три раза в день в течение 7-10 дней (показатель излечения> 95%). Одновременно следует лечить половых партнеров, чтобы предотвратить повторное заражение. Сообщалось о некоторой лекарственной устойчивости, но это не широко распространенная проблема. Неудачи лечения обычно происходят из-за несоблюдения режима лечения или повторного заражения.
|
Трихомониаз как ЗППП |
|
Эпидемиология трихомоноза имеет черты, сходные с другими заболеваниями, передаваемыми половым путем (вставка), а заболеваемость коррелирует с количеством половых партнеров. Кроме того, часто встречается совместная инфекция с другими ЗППП. Подсчитано, что до 25% сексуально активных женщин заразятся в какой-то момент своей жизни, и болезнь передается 30-70% их партнеров-мужчин. Меры, используемые для борьбы с другими ЗППП, такие как ограничение числа половых партнеров и использование презервативов, также эффективны для предотвращения трихомониаза.
Отзывы о трихомониазе:
- Lehker, MW и Alderete, JF (2000) Биология трихомоноза. Current Opinion in Infectious Diseases 13, 37-45 .
- Петрин Д., Делгати К., Бхатт Р., Гарбер Г. (1998) Клинические и микробиологические аспекты Trichomonas vaginalis . Clin. Microbiol. Откр. 11: 300-317 .
- Швебке, Дж. Р. и Берджесс, Д. (2004) Трихомониаз. Обзоры клинической микробиологии 17, 794-803 .
DIENTAMOEBA FRAGILIS
Dientamoeba fragilis первоначально была описана как амеба на основании ее морфологии. Однако позже было установлено, что он имеет морфологию, более похожую на паразита индейки Histomonas meleagridis , за исключением отсутствия жгутиков. Ультраструктурные исследования также предполагают сходство с трихомонадами, включая наличие гидрогеносом, а молекулярные исследования подтвердили тесную филогенетическую связь между Dientamoeba и Histomonas и, возможно, более отдаленную связь с Trichomonas .
Как и у других трихомонад, у Dientamoeba только стадия трофозоитов (рисунок). Это вызывает некоторые вопросы о способе передачи, поскольку стадия цисты обычно связана с фекальной оральной передачей. Кроме того, трофозоиты Dientamoeba очень короткое время выживают вне тела. У H. meleagridis также отсутствует стадия цисты, и было продемонстрировано, что он передается через яйца нематоды. Из-за тесной связи между Histomonas и Dientamoeba предполагается, что Dientamoeba также передается через яйца гельминтов. Эпидемиологические и экспериментальные данные позволяют инкриминировать острицу Enterobius vermicularis в качестве носителя для Dientamoeba . Совсем недавно было показано, что свиньи являются естественными хозяевами для D. fragilis того же генотипа, что и у людей, что повышает вероятность зоонозной передачи ( CacciГ и др., Emerg Infect Dis 18 (5): 838–841, 2012 ).
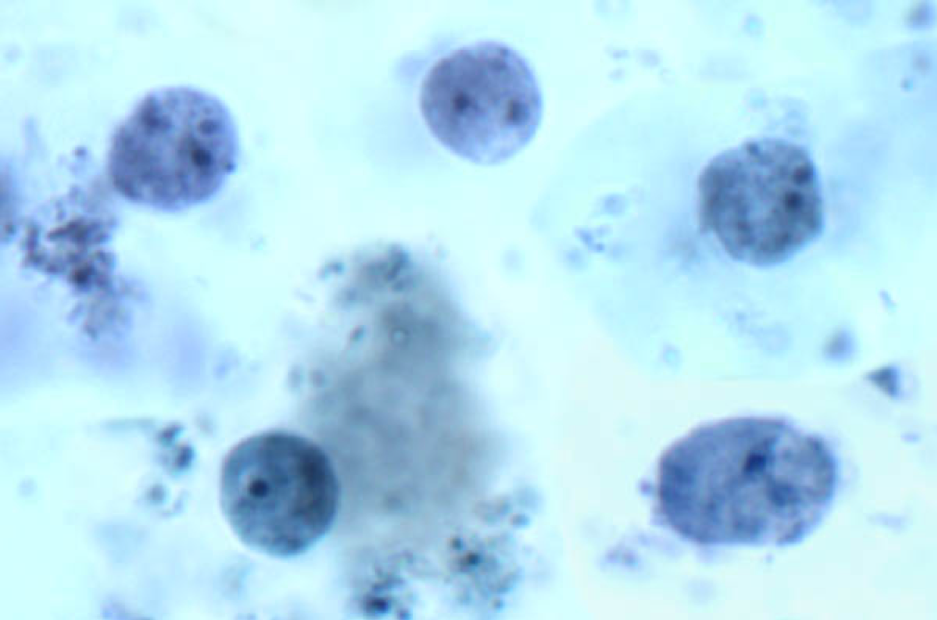
Морфология Dientamoeba fragilis по образцу стула. Трофозоиты имеют амебоподобную морфологию и часто являются двухъядерными.
Исторически Dientamoeba считалась непатогенным комменсалом. Однако клинические симптомы часто коррелируют с наличием большого количества трофозоитов, и лечение инфекции устраняет симптомы. Частота появления симптомов оценивается у 15-30% инфицированных лиц. Клинические симптомы, связанные с Dientamoeba, включают перемежающуюся диарею, боль в животе, метеоризм, тошноту и усталость. Мало что известно о патогенезе, и Dientamoeba, вероятно, действует как слабый раздражитель поверхности слизистой оболочки кишечника, что может привести к воспалению. Йодохинол обычно является препаратом выбора для лечения Dientamoeba . Также эффективны паромомицин и метронидазол.
Обзоры на Dientamoeba
- Джонсон и др. (2004) Выход из неизвестности: биологические, клинические и диагностические аспекты Dientamoeba fragilis. Clin Microbiol Rev 17: 553 .
- Barratt JL et al (2011) Обзор носительства Dientamoeba fragilis у людей: несколько причин, по которым этот организм следует учитывать при диагностике желудочно-кишечных заболеваний. Кишечные микробы 2: 3–12 .
БАЛАНТИДОЗ
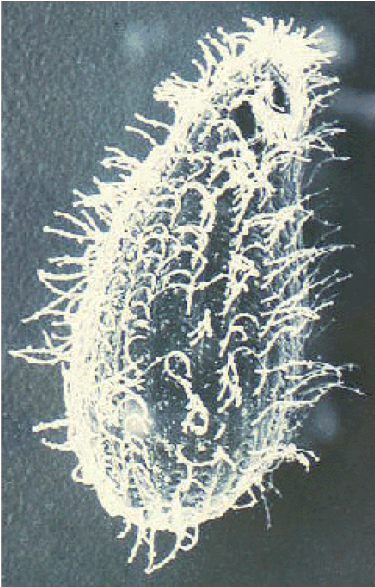 Balantidium coli – единственная инфузория, поражающая человека. Он встречается во всем мире, но, как и многие другие фекально-оральные заболевания, он более распространен в тропиках. Однако показатели распространенности редко превышают 1%. B. coli также поражает множество млекопитающих и особенно часто встречается у обезьян и свиней. Распространенность у свиней колеблется от 20 до 100%, и человеческий балантидиоз обычно проявляет повышенную распространенность в сообществах, которые живут в тесной связи со свиньями. Например, в Папуа-Новой Гвинее, где свиньи являются основным домашним животным, распространенность заболевания среди свиноводов и рабочих на бойнях достигает 28%. Передача от человека к человеку также была задокументирована, и этот способ передачи может иметь место в условиях скопления людей и плохой личной гигиены, таких как психиатрические больницы и тюрьмы. ( Пропустить общую биологию инфузорий )
Balantidium coli – единственная инфузория, поражающая человека. Он встречается во всем мире, но, как и многие другие фекально-оральные заболевания, он более распространен в тропиках. Однако показатели распространенности редко превышают 1%. B. coli также поражает множество млекопитающих и особенно часто встречается у обезьян и свиней. Распространенность у свиней колеблется от 20 до 100%, и человеческий балантидиоз обычно проявляет повышенную распространенность в сообществах, которые живут в тесной связи со свиньями. Например, в Папуа-Новой Гвинее, где свиньи являются основным домашним животным, распространенность заболевания среди свиноводов и рабочих на бойнях достигает 28%. Передача от человека к человеку также была задокументирована, и этот способ передачи может иметь место в условиях скопления людей и плохой личной гигиены, таких как психиатрические больницы и тюрьмы. ( Пропустить общую биологию инфузорий )
ОБЩАЯ ЦИЛИАТНАЯ БИОЛОГИЯ
Инфузории – большая и разнообразная группа простейших. Большинство инфузорий свободны и обитают в самых разных средах обитания. Хорошо известные инфузории включают виды Paramecium , которые встречаются в прудах по всему миру, и Ichthyophthirius multifiliis., эктопаразит рыб, вызывающий болезнь белых пятен (также называемую «икрой»). Как следует из названия, инфузории в какой-то момент своего жизненного цикла обладают ресничками. Реснички обычно расположены продольными рядами и обычно покрывают поверхность организма. Инфузории также характеризуются ядерным диморфизмом в том смысле, что у них есть два отдельных ядра. Большое почковидное макроядро участвует в «хозяйственных» или соматических функциях клетки, тогда как меньшее сферическое микроядро содержит полный геном. Макронуклеус содержит тысячи копий транскрипционно активных «минихромосом», представляющих 10-20 000 различных молекул ДНК.Такое большое количество теломер (концов хромосом) привело к тому, что инфузории стали ранней модельной системой для изучения теломер и теломеразы (фермента, который синтезирует теломеры).
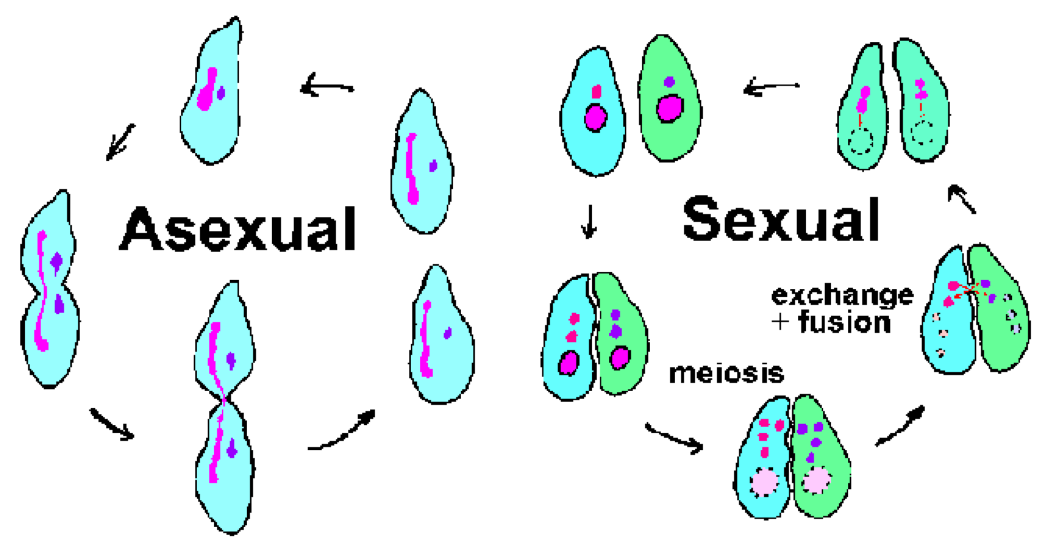
Инфузории подвергаются как бесполому размножению (т. Е. Бинарному делению), так и половому размножению, включающему конъюгацию (рисунок выше). Во время конъюгации две инфузории противоположных типов спариваются и обмениваются генетическим материалом. Конъюгальный контакт запускает мейоз в микроядрах, в результате чего образуются 4 гаплоидных микроядра. Одновременно с этим макронуклеус разрушается и исчезает. Три микроядра распадаются, а оставшееся микроядро снова делится. Каждый из конъюгированных организмов жертвует микроядро (гаметическое или мужское) своему партнеру через цитоплазматический мостик, который их соединяет. Гаметическое микроядро сливается со стационарным (или женским) микроядром, образуя диплоидное зиготическое микроядро. Соединяющаяся пара отделяется, и скуловые ядра подвергаются еще одному раунду деления. Одно из этих микроядер развивается в макронуклеус,таким образом завершая цикл. Формирование макронуклеуса включает фрагментацию хромосом и потерю последовательностей ДНК, соответствующих генам, не экспрессирующимся на высоком уровне во время нормального бесполого цикла. Остальные фрагменты ДНК или минихромосомы затем амплифицируются. (См. Схему обработки ДНК во время формирования макронуклеуса.)
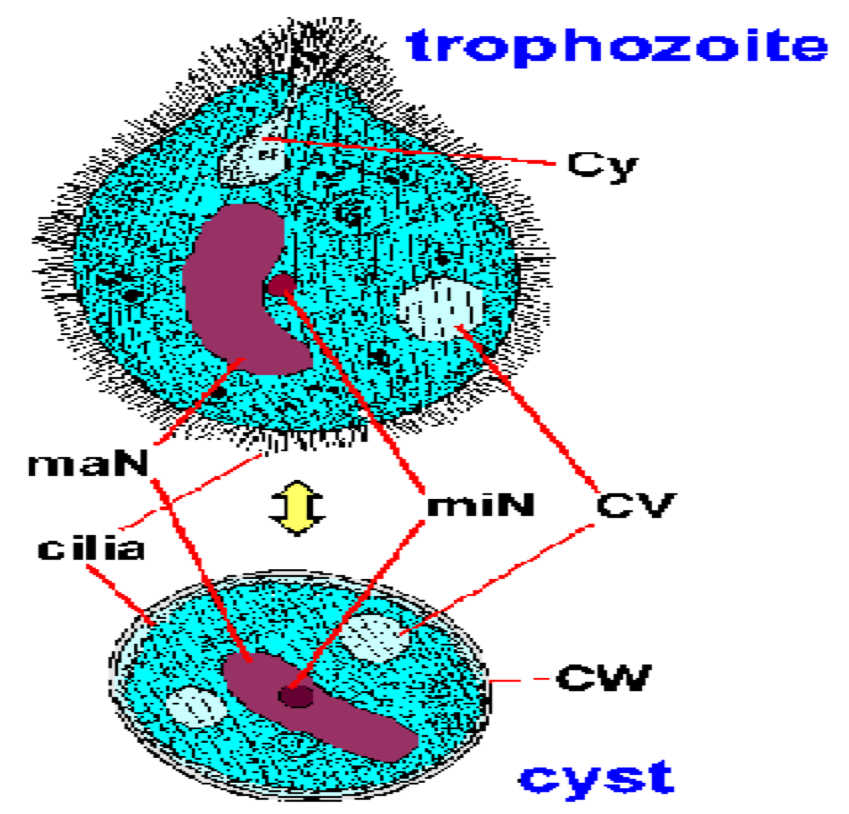
БАЛАНТИДОЗ
B. coli обычно живет как непатогенный комменсал в толстом кишечнике и не вызывает никаких симптомов. Может возникнуть поверхностное воспаление слизистой оболочки толстой кишки, которое может привести к диарее и коликам. Легкие или хронические инфекции характеризуются перемежающейся диареей и запорами, потерей веса и болями в животе. В редких случаях трофозоиты проникают в эпителий кишечника и вызывают язвы. Клинически это приводит к острой диарее со слизью и кровью (например, дизентерии). Эта балантидиальная дизентерия похожа на дизентерию, вызываемую Entameoba histolytica( см. Ниже ). Сообщалось о редких внекишечных инфекциях легких, влагалища, мочеточника и мочевого пузыря, а также о перфорациях кишечника, ведущих к перитониту.
Лабораторный диагноз ставится путем выявления организма в кале. Balantidium демонстрирует типичный фекально-оральный жизненный цикл, состоящий из стадий трофозоита и цисты. Большой размер и уникальные морфологические особенности Balantidium (Рисунок) исключает его маскирование с любыми другими простейшими, обнаруженными в фекалиях человека. Трофозоит имеет яйцевидную форму и имеет средний размер 70 х 45 мкм, но может достигать 150-200 мкм. Циста имеет характерную стенку цисты (CW), более сферическую форму, средний диаметр 55 мкм. В окрашенных образцах наиболее очевидной внутренней структурой является большой макронуклеус (maN). Микронуклеус (miN) не всегда может быть очевиден из-за его тесной связи с макронуклеусом. Часто видны сократительные вакуоли (CV), которые участвуют в осмотической регуляции, и иногда можно обнаружить цитостом (Cy). Как и многие другие инфузории, Balantidium покрыт рядами ресничек. Реснички придают поверхности паразита нечеткий вид и менее выражены на стадии цисты.
Лечением выбора является тетрациклин по 500 мг четыре раза в день в течение 10 дней. Йодохинол – рекомендуемый альтернативный препарат. Метронидазол не дал устойчивых результатов. Профилактические меры такие же, как и при других заболеваниях, передающихся фекально-оральным путем (см. Факторы фекально- оральной передачи или обсуждение профилактики лямблий ). Кроме того, канализация для свиней должна быть удалена от источников питьевой воды и пищи.
АМЕБИАЗ
Некоторые представители рода Entamoeba заражают людей (см. Ниже). Среди них только E. histolytica считается патогенной, а вызываемое ею заболевание называется амебиазом или амебной дизентерией. E. dispar морфологически идентичен E. histolytica, и эти два вида ранее считались одним и тем же. Однако генетические и биохимические данные показывают, что непатогенная E. histolytica является отдельным видом ( см. Обсуждение критериев). Эти два вида встречаются по всему миру, но, как и многие другие кишечные простейшие, они чаще встречаются в тропических странах или других регионах с плохими санитарными условиями. По оценкам, до 10% населения мира могут быть инфицированы либо E. histolytica, либо E. dispar, а во многих тропических странах распространенность может приближаться к 50%. По оценкам, ежегодно регистрируется 50 миллионов случаев амебиаза и до 100 000 случаев смерти.
- Жизненный цикл и морфология
- Патогенез
- Возможные механизмы патогенеза
-
- Схематическое изображение вторжения трофозоитов
- Клиническая презентация
- Диагностика, лечение и контроль
ЖИЗНЕННЫЙ ЦИКЛ И МОРФОЛОГИЯ
E. histolytica демонстрирует типичный фекально-оральный жизненный цикл, состоящий из инфекционных цист, передаваемых с фекалиями, и трофозоитов, которые размножаются в толстом кишечнике. Инфекция передается при попадании цист внутрь, и факторы риска аналогичны другим заболеваниям, передающимся фекально-оральным путем ( см. Таблицу ). Загрязненные продукты питания и вода, вероятно, являются основными источниками инфекции. Более высокая распространенность в районах с более низким социально-экономическим статусом, вероятно, связана с плохой санитарией и отсутствием водопровода. Однако E. histolytica редко является причиной диареи путешественников и обычно связана с длительным (> 1 месяца) пребыванием в эндемичной зоне. Более высокая распространенность E. histolytica.Инфекция также наблюдается в таких учреждениях, как психиатрические больницы, детские дома и тюрьмы, где скученность и проблемы с фекальным заражением являются факторами, способствующими этому. Отмечена также высокая распространенность среди мужчин-гомосексуалистов. Человек – единственный хозяин E. histolytica, и здесь нет резервуаров для животных.
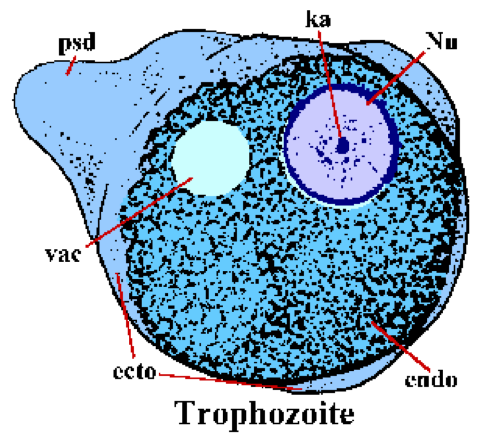 При проглатывании цисты проходят через желудок и удаляются в нижнюю часть тонкой кишки. Эксцистанция включает разрушение стенки цисты, и четырехъядерная амеба выходит через отверстие. Амеба подвергается еще одному циклу деления ядра, за которым следуют три последовательных цикла цитокинеза (т. Е. Деления клеток) с образованием восьми небольших неядерных трофозоитов, иногда называемых амебулами. Эти незрелые трофозоиты колонизируют толстую кишку, особенно слепую и сигмоидоректальную области, где они питаются бактериями и клеточными остатками и подвергаются многократным циклам бинарного деления.
При проглатывании цисты проходят через желудок и удаляются в нижнюю часть тонкой кишки. Эксцистанция включает разрушение стенки цисты, и четырехъядерная амеба выходит через отверстие. Амеба подвергается еще одному циклу деления ядра, за которым следуют три последовательных цикла цитокинеза (т. Е. Деления клеток) с образованием восьми небольших неядерных трофозоитов, иногда называемых амебулами. Эти незрелые трофозоиты колонизируют толстую кишку, особенно слепую и сигмоидоректальную области, где они питаются бактериями и клеточными остатками и подвергаются многократным циклам бинарного деления.
Трофозоиты E. histolytica имеют аморфную форму и обычно составляют 15-30 мкм в диаметре. Трофозоиты перемещаются, вытягивая пальцеобразную псевдоподию (psd) и вытягивая вперед остальную часть тела (это называется амебоидным движением). Псевдоподии, а иногда и внешний край трофозоитов, имеют четкий рефрактильный вид и называются эктоплазмой (экто). Остальная часть цитоплазмы имеет зернистый вид и называется эндоплазмой (эндо). Иногда видна вакуоль гликогена (вакуоль). Ядерная (Nu) морфология в окрашенных образцах характеризуется мелкозернистым кольцом периферического хроматина и центрально расположенной кариосомой (ka).
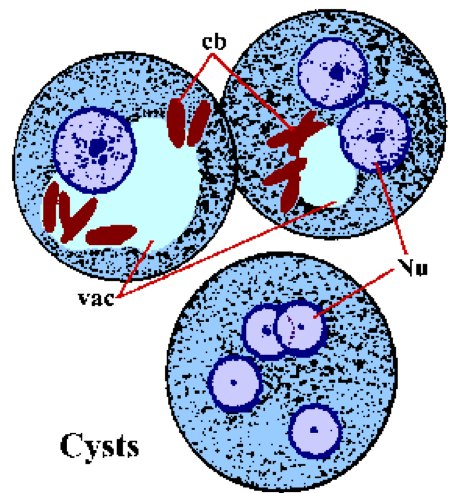 В качестве альтернативы бесполой репликации трофозоиты также могут энцистировать. Факторы, ответственные за индукцию энцистации, неизвестны. Энцистация начинается с того, что трофозоиты становятся более сферическими и появляются хроматоидные тельца в цитоплазме. Хроматоидные тельца (cb) представляют собой окрашенные удлиненные структуры с закругленными концами и представляют собой скопление рибосом. Стенка цисты состоит из хитина и имеет гладкий рефрактерный вид. Созревание цисты включает два раунда репликации ядер без деления клеток, а в кале обнаруживаются цисты с 1-4 ядрами (Nu). Морфология ядра цисты аналогична морфологии трофозоита, за исключением того, что ядра становятся все меньше после каждого деления. Иногда молодые цисты (т. Е.1-2 ядра) будет иметь вакуоль гликогена (vac), которая будет отображаться в виде прозрачной области на окрашенных образцах. Эта вакуоль иногда смещает и изменяет морфологию ядер. Хроматоидные тела имеют тенденцию исчезать по мере созревания цисты. Цисты обычно имеют диаметр 12-15 см. цисты сразу же заразны после выведения с фекалиями и будут оставаться жизнеспособными в течение нескольких недель в зависимости от условий окружающей среды.
В качестве альтернативы бесполой репликации трофозоиты также могут энцистировать. Факторы, ответственные за индукцию энцистации, неизвестны. Энцистация начинается с того, что трофозоиты становятся более сферическими и появляются хроматоидные тельца в цитоплазме. Хроматоидные тельца (cb) представляют собой окрашенные удлиненные структуры с закругленными концами и представляют собой скопление рибосом. Стенка цисты состоит из хитина и имеет гладкий рефрактерный вид. Созревание цисты включает два раунда репликации ядер без деления клеток, а в кале обнаруживаются цисты с 1-4 ядрами (Nu). Морфология ядра цисты аналогична морфологии трофозоита, за исключением того, что ядра становятся все меньше после каждого деления. Иногда молодые цисты (т. Е.1-2 ядра) будет иметь вакуоль гликогена (vac), которая будет отображаться в виде прозрачной области на окрашенных образцах. Эта вакуоль иногда смещает и изменяет морфологию ядер. Хроматоидные тела имеют тенденцию исчезать по мере созревания цисты. Цисты обычно имеют диаметр 12-15 см. цисты сразу же заразны после выведения с фекалиями и будут оставаться жизнеспособными в течение нескольких недель в зависимости от условий окружающей среды.
ПАТОГЕНЕЗ
 E. histolyticaчасто живет как комменсал в толстой кишке без явных клинических проявлений. Однако трофозоиты могут проникать в эпителий толстой кишки и вызывать язвы и дизентерию (см. Вставку). Это инвазивное заболевание может прогрессировать и привести к более серьезному заболеванию. Амебы также могут метастазировать в другие органы и вызывать внекишечный амебиаз. Другими словами,E. histolytica – это факультативный патоген, который проявляет широкий спектр вирулентности.
E. histolyticaчасто живет как комменсал в толстой кишке без явных клинических проявлений. Однако трофозоиты могут проникать в эпителий толстой кишки и вызывать язвы и дизентерию (см. Вставку). Это инвазивное заболевание может прогрессировать и привести к более серьезному заболеванию. Амебы также могут метастазировать в другие органы и вызывать внекишечный амебиаз. Другими словами,E. histolytica – это факультативный патоген, который проявляет широкий спектр вирулентности.
Неинвазивное заболевание часто протекает бессимптомно, но может вызывать диарею или другие желудочно-кишечные симптомы, такие как боль в животе или спазмы. Эта неинвазивная инфекция может сохраняться или прогрессировать до инвазивного заболевания, при котором трофозоиты проникают через слизистую оболочку кишечника и убивают эпителиальные клетки. Раннее поражение представляет собой небольшой участок некроза или язвы с приподнятыми краями и практически без воспаления между очагами (рисунок). Амеба будет распространяться латерально и вниз по подслизистой оболочке (под эпителием) и убивать клетки-хозяева по мере своего развития. Это приводит к классической язве в форме колбы с маленьким отверстием и широким основанием. Трофозоиты наиболее многочисленны на границе здоровой и некротической тканей.Эти инвазивные амебы поедают клетки-хозяева, и трофозоиты с проглоченными эритроцитами часто очевидны. Эти гематофагные трофозоиты иногда обнаруживаются в дизентерийных фекалиях. Производство цист уменьшается на инвазивной стадии инфекции, и цисты никогда не обнаруживаются в пораженных тканях.
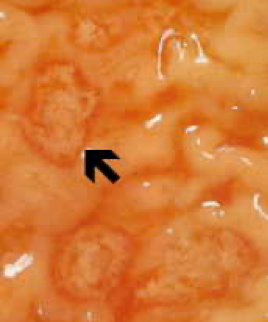
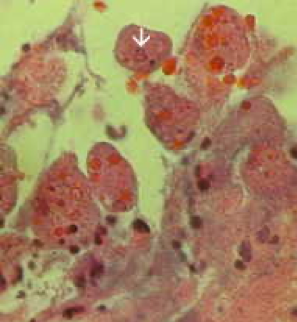
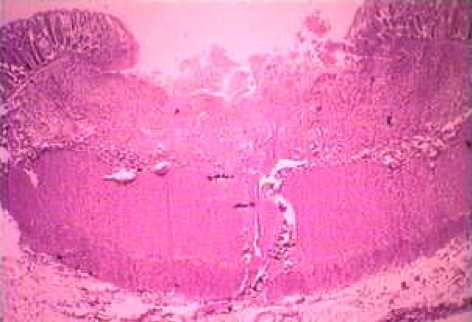
Слева: на просветной стороне толстой кишки из случая молниеносного амебиаза видно несколько язв. Обратите внимание на выступающие края (стрелка). В центре: гистологический препарат, показывающий поперечный разрез язвы. Обратите внимание на высокую степень некроза в центре язвы. Амебы продвигаются латерально под неповрежденной слизистой оболочкой, на что указывают микроворсинки. Справа: при большем увеличении язва показывает несколько гематофагов трофозоитов. Ядро (стрелка) видно у одной из амеб. Рисунки из Peters and Gilles (1989), Цветной атлас тропической медицины и паразитологии (3-е издание).
E.histolytica обнаруживается в основном в толстой кишке, где он может жить как непатогенный комменсал или проникать в слизистую оболочку кишечника (зеленый). Амеба может метастазировать в другие органы гематогенным путем (пурпурный); в первую очередь затрагивает воротную вену и печень. Амеба также может распространяться путем прямого распространения (синий цвет), вызывая легочную инфекцию, кожные поражения или перианальные язвы.
Язвенный процесс может продолжать расширяться в стороны или вниз. Если имеется большое количество язв, они могут срастаться, что может привести к локальному отслаиванию стенки кишечника. Расширение язвы также может проникнуть в серозный слой и привести к перфорации стенки кишечника. Эта перфорация может привести к местным абсцессам или генерализованному перитониту. (См. Также схематическое изображение инвазии в ткани .) Амебные язвы также могут быть вторично инфицированы бактериями, что может нарушить клиническую картину. Кроме того, инфекция E. histolytica может иногда приводить к образованию амебной гранулемы, также называемой амебомой. Амебома – это воспалительное утолщение стенки кишечника вокруг язвы, которое можно принять за опухоль.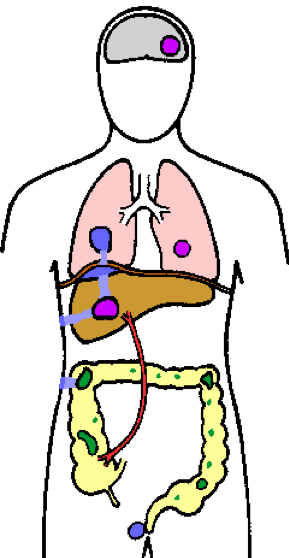
Амебиаз также может прогрессировать в системную или внекишечную инфекцию. Распространение из первичного поражения кишечника происходит преимущественно через кровоток, но также может происходить путем прямого распространения поражения. Чаще всего поражается печень, и это, вероятно, связано с прямым переносом трофозоитов из толстой кишки в печень через воротную вену печени (рисунок). Первоначально поражения представляют собой небольшие очаги некроза, которые по мере расширения имеют тенденцию сливаться в единый абсцесс. Этот абсцесс печени будет продолжать увеличиваться по мере того, как трофозоиты постепенно разрушают и поглощают клетки-хозяева. Центр абсцесса, состоящий из лизированных гепатоцитов, эритроцитов, желчи и жира, может разжижаться, и этот некротический материал (иногда неправильно называемый гноем) будет иметь цвет от желтоватого до красновато-коричневого. Вторичные бактериальные инфекции в абсцессе печени встречаются нечасто (~ 2%).
Гематогенное распространение трофозоитов в другие органы, например в легкие или мозг, встречается редко, но все же происходит. Вторым по распространенности внекишечным участком после печени являются легкие. Легочные инфекции обычно возникают в результате прямого распространения поражения печени через диафрагму на плевру и легкие. Кожные поражения, образованные в результате печеночной или кишечной фистулы, также могут возникать, хотя и крайне редко. Другие кожные поражения включают перианальные язвы и поражение гениталий, в том числе полового члена гомосексуалистов. Эти более поздние проявления, вероятно, связаны с контактом кожи или слизистых оболочек с инвазивными трофозоитами.
ВОЗМОЖНЫЕ МЕХАНИЗМЫ ПАТОГЕНЕЗА
| Entamoeba тот показатель |
|
Как обсуждалось выше , E. histolytica является патогеном, который проявляет широкий спектр вирулентности, от авирулентного комменсала до высокоинвазивного и деструктивного организма (см. Обсуждение патогенности и вирулентности ). Отчасти это различие в вирулентности объясняется существованием морфологически идентичного, но невирулентного E. dispar . E. dispar никогда не был связан с симптоматическим инвазивным заболеванием, и инфекция не вызывает сывороточных антител. Напротив, гуморальные реакции против амебы наблюдаются как у бессимптомных, так и у симптоматических E. histolytica.инфекции. Это говорит о том, что даже в бессимптомных случаях инвазия ограничена. Однако инфицирование E. histolytica не всегда приводит к инвазивному заболеванию, поскольку только у около 10% инфицированных людей разовьётся симптоматический инвазивный амебиаз. Факторы, ответственные за патогенез E. histolytica , недостаточно изучены. Один из подходов к пониманию патогенеза – это сравнение возможных факторов вирулентности между этими двумя близкородственными видами.
| Возможные факторы вирулентности |
факторы хозяина
паразитарные факторы
|
Патология возникает в результате взаимодействий между хозяином и паразитом, и, следовательно, факторы хозяина, факторы паразита или их комбинация могут вносить вклад в болезненное состояние. Например, развитие инвазивного заболевания может быть связано с количественными или качественными аспектами иммунного ответа хозяина. Рекрутинг нейтрофилов и интенсивное воспаление отмечаются на ранних этапах амебной инвазии. Однако воспаление вокруг уже сформировавшихся язв и абсцессов часто бывает минимальным, учитывая степень повреждения тканей.
Природа защитных иммунных ответов не ясна. Врожденный или неспецифический иммунитет, а также приобретенный иммунитет, вероятно, важны для предотвращения инвазивных заболеваний. Слизистый слой, покрывающий эпителиальные клетки, может предотвратить контакт между трофозоитом и клетками- хозяевами. Кроме того, IgA-ответы слизистой оболочки действительно возникают в результате инфекции, а фекальные IgA-антитела против трофозоитного поверхностного лектина ( см. Eh-лектин ) связаны с более низкой частотой появления новых E. histolytica.инфекции. Высокие титры сывороточных антител также развиваются у пациентов с абсцессами печени. Однако, поскольку инвазивное заболевание часто прогрессирует и не проходит, роль этих антител против амеба остается под вопросом. Клеточно-опосредованные ответы, по-видимому, играют роль в ограничении степени инвазивного амебиаза и защите хозяина от рецидива после успешного лечения.
Устойчивость к иммунному ответу хозяина – еще один возможный фактор вирулентности, который может способствовать развитию и обострению инвазивного заболевания. Например, одним из фенотипических различий между E. dispar и E. histolytica является устойчивость последнего к лизису, опосредованному комплементом ( см. E. dispar ). Кроме того, E. histolytica быстро разрушает секреторный IgA и, возможно, подавляет ответы Т-клеток на антигены E. histolytica . E. histolytica также способен убивать клетки, включая нейтрофилы и другие иммунные эффекторные клетки, в зависимости от контакта. Лизис нейтрофилов может также выделять токсичные продукты, которые способствуют разрушению ткани хозяина. Однако роль этих различных явлений в патогенезе неизвестна.
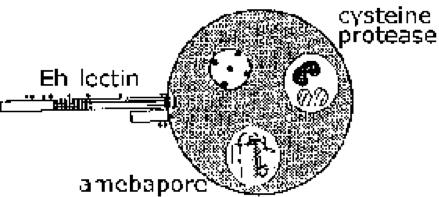
Инвазия слизистой оболочки кишечника E. histolytica – это активный процесс, опосредованный паразитом, и можно распознать отдельные этапы (рисунок, и подробная легенда). Трофозоиты прикрепляются к слизистому слою (шаг 1). Это прилипание само по себе, вероятно, не способствует патогенезу и является просто механизмом ползания амебы по субстрату. Разрушение слизистого барьера позволяет трофозоиту вступать в контакт с эпителиальными клетками. Эпителиальные клетки погибают в зависимости от контакта, что приводит к разрушению слизистой оболочки кишечника (этап 2). Трофозоиты будут продолжать убивать клетки-хозяева в подслизистой оболочке и далее разрушать ткань по мере продвижения (шаг 3). Также возможно нарушение стенки кишечника (этап 4) или метастазирование через систему кровообращения (этап 5). Прилипание, цитотоксичность и разрушение тканей являются важными факторами патогенеза E. histolytica.. Белки паразитов, которые могут играть роль в этих процессах, включают: Eh-лектин , амебапор и протеазы .
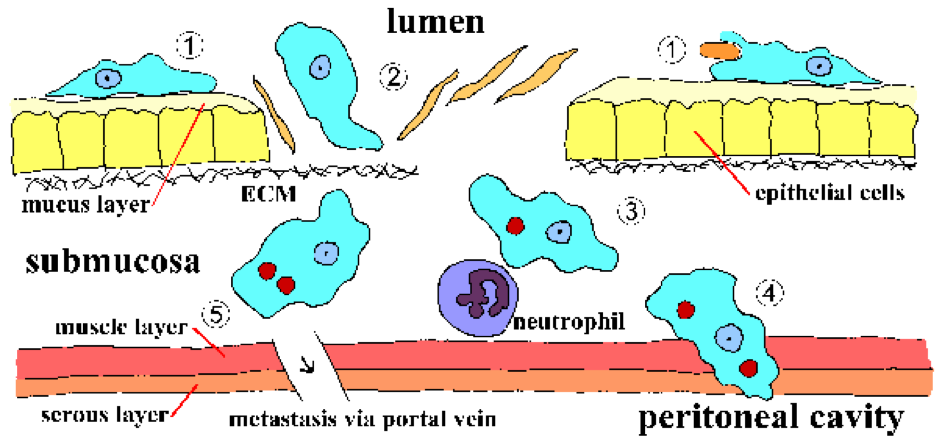
( Можно пропустить подробное обсуждение Eh-лектина, амебапура и протеаз и перейти к клиническим симптомам. )
Э-лектин. E. histolytica может убивать клетки в течение нескольких минут после прикрепления к ним в присутствии внеклеточного кальция. Приверженность E. histolytica трофозоиты к клеткам-хозяевам и муцинам толстой кишки опосредуются лектиновой активностью, выраженной на поверхности амебы. Этот лектин связывает галактозу или N-ацетил-D-галактозамин (GalNAc) с высоким сродством, и его также называют ингибирующим галактозу белком адгезии (GIAP) или лектином Gal / GalNAc. Контактно-зависимое уничтожение клеток-мишеней почти полностью ингибируется галактозой или GalNAc, а клетки-мишени, лишенные концевых остатков галактозы на своих поверхностных гликопротеинах, устойчивы к адгезии трофозоитов и цитотоксичности. Это говорит о том, что лектин Gal / GalNAc является важным фактором вирулентности. Кроме того, Eh-лектин участвует в устойчивости к лизису, опосредованному комплементом. Из-за его потенциальной роли в приверженности и вирулентности, а также поскольку фекальный IgA против него защищает от амебного колита, то Gal / GalNAc является кандидатом на вакцину (Petri et al, 2006,Arch. Med. Res. 37: 288 ).
Eh-лектин представляет собой гетеродимер, состоящий из тяжелой цепи 170 кДа и легкой цепи 31-35 кДа, соединенных дисульфидными связями. Промежуточная субъединица 150 кДа нековалентно связана с гетеродимером. Тяжелая цепь имеет трансмембранный домен и домен связывания углеводов. Все субъединицы кодируются мультигенными семействами. Есть пять членов семейства тяжелых цепей, 6-7 членов семейства легких цепей и 30 членов семейства промежуточных цепей. Члены семейства генов тяжелой цепи демонстрируют 89-95% идентичности последовательностей на аминокислотном уровне, тогда как члены семейства легких цепей менее консервативны, разделяя только 79-85% идентичности последовательностей.
E. disparтакже экспрессирует на своей поверхности лектин Gal / GalNAc. ИE. dispar, и E. histolytica должны прилипать к слизистому слою, который обрабатывается лектином Gal / GalNAc. Слизь состоит из гликопротеинов, называемых муцинами. Преобладающим муцином, обнаруживаемым на слизистой оболочке кишечника, является Muc2, который сильно гликозилирован О-связанными остатками GalNAc. Последовательности генов легкой и тяжелой цепей E. dispar гомологичны, но не идентичны последовательностям E. histolytica . Антигенные различия между GIAP E. dispar и E. histolytica также были описаны в том, что только два эпитопа из шести являются общими для двух видов ( см.E. dispar ). Неизвестно, могут ли эти различия в последовательностях объяснять различия в вирулентности между E. dispar и E. histolytica . Приверженность, очевидно, важна для обоих видов, но возможно, что приверженность качественно или количественно различается между двумя видами.
[Обзор Eh-lectin: Petri et al (2002) Annu. Rev. Microbiol. 56:39 .]
Амебапур. Семейство порообразующих полипептидов было идентифицировано у E. histolytica и E. dispar . Три члена семьи обозначены как амебапур A, B и C, причем амебапур A является преобладающим выражением. Зрелый полипептид имеет длину 77 аминокислот и образует димеры при низком pH (4-6). Затем три из этих димеров собираются в полую кольцевую структуру. Этот гексамер затем может интеркалироваться в мембраны и вводить поры размером 2 нм (т.е. отверстия), что приводит к гибели клеток. Активность порообразования зависит от этого процесса сборки, начиная с димеризации. Amebabpore A на 95% идентичен (т. Е. Четыре остатка различны) между E. histolytica и E. dispar . Кроме того, E. disparамебапур обладает примерно половиной порообразующей активности, как и амебапур E. histolytica . Это различие в порообразующей активности было приписано остатку глутамата в положении 2 в E. histolytica amebapore по сравнению с остатком пролина в E. dispar amebapore. Этот конкретный аминокислотный остаток важен для образования димеров, и считается, что димеры E. dispar amebapore менее стабильны.
Амебапур локализован в вакуолярных компартментах (например, пищевых вакуолях) внутри трофозоита и наиболее активен при кислом pH, что позволяет предположить, что основная функция амебапура – лизировать проглоченные бактерии. Тем не менее, амебапур участвует в качестве фактора вирулентности в том, что генетические манипуляции с E. histolytica, приводящие к снижению экспрессии амебапура, приводят к снижению патогенности (способности образовывать абсцессы печени), а также к снижению бактерицидной активности (Bracha et al . Microbiol. 34: 363 , 1999). Точно так же модифицированные E. histolytica, полностью лишенные продукции амебапура, неспособны образовывать абсцессы печени в модельных системах (Zhang et al, Inf. Imm. 72: 678, 2004). Однако эти амебы способны вызывать воспаление и повреждение тканей в моделях амебного колита.
[Обзор амебапура: Leippe et al, Tr. Паразитол. 21: 5 , 2005.]
Протеазы. Протеазы – это ферменты, которые разрушают другие белки и могут вносить вклад в патогенез, вызванный E. histolytica . В этом отношении E. histolytica экспрессирует и секретирует более высокие уровни цистеиновых протеаз, особого класса протеаз, чем E. dispar . Было показано, что цистеиновые протеазы нарушают полимеризацию MUC2, основного компонента слизи толстой кишки. Эта разложившаяся слизь менее эффективно блокирует прикрепление трофозоитов к эпителиальным клеткам. Разрушение внеклеточного матрикса (ЕСМ) протеазами также может способствовать инвазии трофозоитов. Ингибиторы цистеиновых протеаз могут уменьшать размер абсцесса печени в экспериментальных моделях.
| Фактор |
histolytica против dispar |
| Э-лектин | различия в последовательностях и эпитопах |
| амебапур | У Эда меньше активности (Pro / Glu) |
| протеазы | Eh имеет уникальные гены и проявляет большую активность |
| Рисунок Хорстманна и др. (1992) Trop. Med. Паразитол. 43, 213. | |
 У E. histolytica идентифици- ровано двадцать различных генов цистеиновых протеаз . Ортологи двух генов цистеиновых протеаз E. histolytica не обнаружены у E. dispar . Один из них, обозначенный CP5, экспрессируется на высоких уровнях на поверхности трофозоитов. Мутанты, экспрессирующие более низкие уровни CP5, обладали пониженной способностью генерировать абсцессы печени в модели амебиаза хомяка. Однако эти мутанты также имели пониженную скорость роста и более низкую эритрофагоцитарную активность, поэтому неясно, участвует ли CP5 напрямую в инвазивности E. histolytica . Кроме того, ингибирование 90% активности CP5 не влияло на способность E. histolyticaтрофозоиты для разрушения монослоев клеток in vitro. CP1, CP2 и CP5 являются наиболее часто экспрессируемыми цистеиновыми протеазами у E. histolytica , тогда как CP3 наиболее широко экспрессируются у E. dispar. Интересно, что сверхэкспрессия CP2 в E. dispar увеличивает способность трофозоитов разрушать клеточные монослои in vitro. Однако сверхэкспрессия CP2 не привела к способности E. dispar образовывать абсцессы печени у песчанок. Следовательно, неясно, какие именно роли протеазы могут играть в патогенезе.
У E. histolytica идентифици- ровано двадцать различных генов цистеиновых протеаз . Ортологи двух генов цистеиновых протеаз E. histolytica не обнаружены у E. dispar . Один из них, обозначенный CP5, экспрессируется на высоких уровнях на поверхности трофозоитов. Мутанты, экспрессирующие более низкие уровни CP5, обладали пониженной способностью генерировать абсцессы печени в модели амебиаза хомяка. Однако эти мутанты также имели пониженную скорость роста и более низкую эритрофагоцитарную активность, поэтому неясно, участвует ли CP5 напрямую в инвазивности E. histolytica . Кроме того, ингибирование 90% активности CP5 не влияло на способность E. histolyticaтрофозоиты для разрушения монослоев клеток in vitro. CP1, CP2 и CP5 являются наиболее часто экспрессируемыми цистеиновыми протеазами у E. histolytica , тогда как CP3 наиболее широко экспрессируются у E. dispar. Интересно, что сверхэкспрессия CP2 в E. dispar увеличивает способность трофозоитов разрушать клеточные монослои in vitro. Однако сверхэкспрессия CP2 не привела к способности E. dispar образовывать абсцессы печени у песчанок. Следовательно, неясно, какие именно роли протеазы могут играть в патогенезе.
Таким образом, патогенез, связанный с инфекцией E. histolytica, в первую очередь обусловлен ее способностью проникать в ткани и убивать клетки-хозяева. Выявлено несколько потенциальных факторов вирулентности (см. Таблицу). Однако неясно, какую роль эти различные факторы вирулентности играют в развитии инвазивного заболевания. Один из подходов к пониманию патогенеза – сравнение этих факторов из E. histolytica и E. dispar.. Эти два вида тесно связаны, и потенциальные факторы вирулентности обнаружены у обоих видов. Приверженность, цитолитическая активность и протеолитическая активность являются биологическими свойствами, присущими обоим видам, и эти активности не обязательно приводят к патологии. Однако существуют качественные и количественные различия между E. histolytica и E. dispar, которые могут объяснить различия в вирулентности. Эти генетические различия между E. histolytica и E. disparуказывают на то, что патогенез частично является врожденной особенностью паразита. Однако патогенез, вероятно, обусловлен комбинированным действием нескольких факторов хозяина и паразита, а вирулентность может отражать степень, в которой хозяин может контролировать инвазию и репликацию трофозоитов.
[См. Huston, 2004, Tr. Паразитол. 20:23 или Ральстон и Петри, 2011, Тр. Паразитол. 27: 253 с обзорами патогенеза.]
КЛИНИЧЕСКАЯ ПРЕЗЕНТАЦИЯ
Амебиаз представляет собой широкий спектр клинических синдромов (таблица), которые отражают способность E. histolytica стать инвазивной и вызвать прогрессирующее заболевание . Инкубационный период может составлять от нескольких дней до месяцев или лет, наиболее часто – 2–4 недели. Может произойти переход от одного типа кишечного синдрома к другому, а кишечные инфекции могут привести к возникновению внекишечных инфекций.
| Клинические синдромы, связанные с амебиазом |
Кишечное заболевание
Внекишечное заболевание
|
Большинство людей с диагнозом E. histolytica (или E. dispar ) не проявляют никаких симптомов или имеют неопределенные и неспецифические абдоминальные симптомы. Это состояние может сохраняться или прогрессировать до симптоматической инфекции. Симптоматические недизентерийные инфекции проявляются различными симптомами, от легких и преходящих до интенсивных и длительных. Типичные симптомы включают: диарею, судороги, метеоризм, тошноту и анорексию. Диарея часто чередуется с периодами запора или мягкого стула. Стул иногда содержит слизь, но видимой крови нет.
Амебная дизентерия обычно начинается медленно в течение нескольких дней с спазмов в животе, тенезмов и иногда жидкого стула, но прогрессирует до диареи с кровью и слизью. Кровь, слизь и кусочки некротической ткани становятся более очевидными по мере увеличения количества стула (10-20 и более в день), и стул часто будет содержать мало фекального материала. У некоторых пациентов может развиться лихорадка, рвота, болезненность живота или обезвоживание (особенно у детей) по мере увеличения тяжести заболевания. Фульминантный или грангренозный колит – редкая, но чрезвычайно тяжелая форма кишечного амебиаза. Пациенты поступают с тяжелой кровавой диареей, лихорадкой и диффузной болезненностью в животе. Поражается большая часть слизистой оболочки, а смертность превышает 50%. Хронический амебиаз,также могут возникать периодические приступы дизентерии с промежуточными периодами легких или умеренных желудочно-кишечных симптомов.
Амебомы представляют собой болезненные образования в брюшной полости, которые чаще всего возникают в слепой и восходящей ободочной кишке. Обструктивные симптомы или кровотечения также могут быть связаны с амебомой. Амебомы встречаются нечасто и их можно спутать с карциномами или опухолями. Перианальные язвы – это форма кожного амебиаза, возникающая в результате прямого распространения кишечной инфекции.
Амебные абсцессы печени – наиболее частая форма внекишечного амебиаза. Появление печеночных симптомов может быть быстрым или постепенным. Инфекции печени характеризуются гепатомегалией, болезненностью печени, болью в правом верхнем квадранте, лихорадкой и анорексией. Лихорадка иногда возникает ежедневно днем или вечером. Функциональные пробы печени обычно нормальные или слегка ненормальные, желтуха – необычное явление. Абсцессы печени иногда прорываются в брюшину, что приводит к перитониту.
Легочный амебиаз обычно возникает в результате прямого распространения абсцесса печени через диафрагму. Клинические симптомы чаще всего включают кашель, боль в груди, одышку (затрудненное дыхание) и лихорадку. Мокрота может быть гнойной или окрашенной кровью и содержать трофозоиты. Также может произойти обильная мокрота (т. Е. Рвота) гнойного материала. Первичные метастазы в легкие случаются редко. Точно так же редко встречается инфекция других органов (например, головного мозга, селезенки, перикарда). Клинические симптомы связаны с пораженным органом.
Кожный амебиаз – это результат омывания кожи или слизистых оболочек жидкостями, содержащими трофозоиты. Этот контакт может быть результатом свища (кишечного, печеночного, промежностного) или вторжения в гениталии. Кожные поражения имеют влажную, зернистую, некротическую поверхность с выступающими краями и могут быть очень разрушительными. Клинический диагноз сложен и обычно рассматривается с учетом эпидемиологических факторов риска (например, эндемичные районы, мужской гомосексуализм и т. Д.).
ДИАГНОСТИКА, ЛЕЧЕНИЕ И КОНТРОЛЬ
|
Диагностика |
Кишечное заболевание
Внекишечное (печеночное) заболевание
|
Окончательный диагноз амебиаза требует выявления цист или трофозоитов E. histolytica в кале или тканях. Образцы стула следует консервировать, окрашивать и исследовать под микроскопом. цисты будут иметь тенденцию преобладать в сформированном стуле и трофозоитах в диарейном стуле ( см. Морфологию ). Свежий стул также можно немедленно исследовать на предмет подвижных трофозоитов, которые проявляют прогрессирующую подвижность. Сигмоидоскопия может выявить характерные язвы, особенно при более тяжелом течении болезни. Аспираты или биопсии также следует исследовать под микроскопом на наличие трофозоитов.
E. histolyticaиE. dispar нельзя различить по морфологическим критериям. Доступны наборы для обнаружения антигена для положительной идентификации этих видов. Одним из таких тестов быстрого обнаружения антигенов является E. HISTOLYTICA QUIK CHEK (TechLab, Inc).
Серология особенно полезна для диагностики внекишечного амебиаза. Более чем у 90% пациентов с инвазивным колитом и абсцессами печени выявляются сывороточные антитела против E. histolytica . Однако антитела могут сохраняться годами, и различение прошлых и текущих инфекций может создавать проблемы в эндемичных районах. Неинвазивные методы визуализации (например, ультразвук, КТ, МРТ) могут использоваться для обнаружения абсцессов печени. Также возможна аспирация абсцессов печени. Однако это делается редко и только в отдельных случаях (например, серология и визуализация недоступны, терапевтические цели). Аспират обычно представляет собой густую красновато-коричневую жидкость, редко содержащую трофозоиты. Трофозоиты чаще всего обнаруживаются на стенке абсцесса, а не в некротических остатках в центре абсцесса.
Для лечения амебиаза доступно несколько лекарств, и выбор лекарств зависит от клинической стадии инфекции (таблица). Прогноз после лечения в неосложненных случаях обычно благоприятный. В случаях, когда E. histolytica подтверждена или вид (например, dispar или histolytica) неизвестен, следует лечить бессимптомных прохождений цисты, чтобы предотвратить прогрессирование заболевания до тяжелого и контролировать распространение заболевания. Однако во многих эндемичных районах, где частота повторного заражения высока, а лечение дорогое, стандартной практикой является лечение только симптоматических случаев. Метронидазол или тинидазол (при наличии) рекомендуется при всех симптоматических инфекциях. Это лечение должно сопровождаться или сочетаться с люменальными антиамебными препаратами, как описано для бессимптомных пациентов.
Лечение амебиаза |
||||||||
|
В случаях молниеносного амемического колита или перфорации кишечной стенки для лечения кишечных бактерий в брюшине можно также использовать антибиотики широкого спектра действия. Некротический колит требует срочной госпитализации для восстановления водно-электролитного баланса. Кроме того, иногда одновременно с нитроимидазолом вводят эметин или дегидроэметин. Это делается только в самых тяжелых случаях из-за токсичности этих препаратов. Также может потребоваться операция для закрытия перфорации или частичной колостомы. Абсцессное дренирование поражений печени (например, пункционная аспирация или хирургический дренаж) в настоящее время редко выполняется в терапевтических целях и показано только в случаях больших абсцессов с высокой вероятностью разрыва.
Профилактика и меры борьбы похожи на другие заболевания , передающиеся фекально-оральным путем (см Факторы риска и обсуждение Giardia контроля ). Основное различие заключается в том, что люди являются единственным хозяином для E. histolytica и нет возможности передачи зоонозов. Контроль основан на недопущении загрязнения пищи или воды фекалиями. Санитарное просвещение в отношении улучшения личной гигиены, санитарного удаления фекалий и мытья рук особенно эффективны. Защита источников воды снизит эндемичность и эпидемии. Как Лямблии , Энтамоебацисты устойчивы к стандартной обработке хлором, но погибают от йода или кипячения. Процессы осаждения и фильтрации довольно эффективны при удалении цист Entamoeba . Химиопрофилактика не рекомендуется.
Отзывы об амебиазе:
- Хак, Р. и др. (2003) Амебиаз. N. Engl. J. Med. 348: 1565 .
- Стэнли, С.Л. (2003) Амебиаз. Ланцет 361: 1025 .
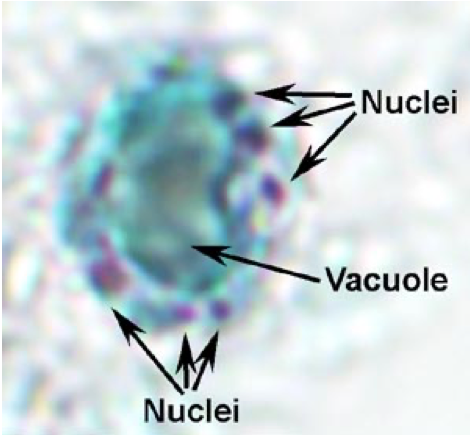
BLASTOCYSTIS HOMINIS
Blastocystis hominis – часто встречающийся в стуле человека организм. С момента своего первоначального описания примерно 100 лет назад, он был по-разному классифицирован как амеба, дрожжевой грибок, спорозойное животное и стадия цисты жгутиконосца. Анализ последовательности малой субъединицы рРНК показывает, что Blastocystis наиболее тесно связана со страменопилами, сложным комплексом одноклеточных и многоклеточных протистов. К другим страменопилам относятся диатомовые водоросли, бурые водоросли и водяная плесень. Многие характеристики Blastocystis неизвестны или спорны. Способ передачи, механизм репликации клеток и другие особенности жизненного цикла окончательно не продемонстрированы.
 Точно так же статус Blastocystis как патоген, комменсал или условно-патогенный организм неизвестен.
Точно так же статус Blastocystis как патоген, комменсал или условно-патогенный организм неизвестен.
Blastocystis полиморфна в том смысле , что различные морфологические формы обнаруживаются в кале и культуре in vitro. Наиболее широко известна сферическая форма диаметром 10-15 мкм с большой центральной вакуолью (рисунок). Эта большая вакуоль выталкивает ядра и другие органеллы к периферии клетки. Вакуоль иногда заполнена зернистым материалом. Небольшие устойчивые цистоподобные формы были идентифицированы в культурах in vitro и иногда наблюдались в кале. Эти предполагаемые цисты имеют размер примерно 5 мкм и окружены многослойной стенкой. Кроме того, цисты не лизируются при помещении в воду, что позволяет предположить, что они устойчивы к условиям окружающей среды. Предположительно Blastocystis передается фекально-оральным путем. Однако это не было окончательно продемонстрировано.
Было несколько сообщений, предполагающих, что Blastocystis вызывает заболевание, а также множество сообщений, предполагающих обратное. Диарея, судороги, тошнота, рвота и боль в животе связаны с большим количеством микроорганизмов в стуле. Кроме того, некоторые исследования показали, что лечение облегчает симптомы и выводит микроорганизмы. Однако препараты, используемые против Blastocystis (например, метронидазол), также работают против многих других кишечных простейших и бактерий. Неспособность исключить другие организмы как источник симптомов и наблюдение, что многие инфицированные люди не проявляют никаких симптомов, затрудняет какие-либо окончательные выводы о патогенезе Blastocystis . Кроме того, возможно, что Blastocystisв первую очередь является комменсалом, но может проявлять вирулентность в определенных условиях хозяина, таких как сопутствующие инфекции, плохое питание или иммуносупрессия.
Blastocystis также встречается у широкого круга животных, включая млекопитающих, птиц, рептилий, земноводных и даже насекомых, и демонстрирует широкий диапазон молекулярного разнообразия. Генетическое расстояние между изолятами Blastocystis больше, чем генетическое расстояние между E. histolytica и E. dispar ( см. Обсуждение E. dispar ). Это усложняет определение видов, и исторически изоляты человека обозначались как B. hominis, а изоляты для других хозяев – как Blastocytis sp. Однако филогенетический анализ показывает, что не существует исключительно человеческих клад, а человеческие изоляты встречаются во всех кладах. Это повышает вероятность того, чтоBlastocystis не зависит от хозяина и может передаваться зоонозно. Кроме того, широкий диапазон генетического разнообразия может объяснить разногласия относительно патогенности Blastocystis тем, что некоторые генотипы могут быть более вирулентными, чем другие. Однако исследования, посвященные этой проблеме, показывают, что это не так. Разрешение путаницы в отношении таксономии, передачи и вирулентности Blastocystis потребует дополнительных исследований.
Отзывы о Blastocystis :
- Кларк К.Г., ван дер Гизен М., Альфеллани М.А., Стенсволд С.Р. (2013) Последние достижения в исследованиях бластоцист . Успехи в паразитологии 82, 1-32 .
- Scanlan PD (2012) Blastocystis : прошлые ловушки и перспективы на будущее. Тенденции в паразитологии 28, 327-334 .
- Tan KSW, Mirza H, Teo JDW, Wu B, MacAry PA (2010) Текущие взгляды на клиническую значимость Blastocystis spp. Текущие отчеты об инфекционных заболеваниях 12, 28-35 .
НЕПАТОГЕННЫЕ КОММЕНТАРИИ
Многочисленные простейшие могут населять желудочно- кишечный тракт человека. У большинства из них явная патология незначительна или отсутствует. Заражение этими простейшими свидетельствует о фекальном заражении и указывает на риск более серьезных инфекций, таких как Giardia или E. histolytica . Эти непатогенные виды также можно спутать с потенциально патогенными лямблиями или E. histolytica, что приведет к ненужному медикаментозному лечению. Кроме того, такой ошибочный диагноз также проблематичен, поскольку может быть упущена истинная причина симптомов и соответствующее лечение будет отложено.
- Другой Entamoeba
- Другие кишечные амебы
- Другие кишечные жгутики
- Бластоцисты
|
Виды Entamoeba, заражающие людей
Некоторые виды Entamoeba заражают людей (вставка). E. histolytica может вызывать тяжелое кишечное заболевание, характеризующееся дизентерией, а также инвазивное заболевание, поражающее в первую очередь печень (см. Амебиаз ). E. dispar морфологически идентичен E. histolytica , но не вызывает инвазивного заболевания (см. Дальнейшее обсуждение E. dispar ). Отличительной особенностью Entamoeba является их морфология ядра, которая описывается как наличие периферического хроматина и небольшой кариосомы. E. histolytica / dispar , E.coli и E. hartmanni можно отличить по размеру и незначительным морфологическим отличиям (см. таблицу).
|
Кишечные виды Entamoeba |
|||||||||||||||
* = E. histolytica ; ** инвазивный E. histolytica может быть> 20 мм. |
E. coliявляется самой крупной и лучше всего выделяется в зрелой цисте по 8 ядрам. ТрофозоитыE. coli трудно отличить от E. histolytica / dispar, поскольку есть некоторое перекрытие в диапазонах размеров. E. hartmanni очень похож на E. histolytica и ранее считался «небольшой расой» E. histolytica . Обычно 10 мкм выбирают в качестве границы между E. histolytica и E. hartmanni .
E. Pockiобычно связывают со свиньями и обезьянами, но случаи заболевания людей иногда задокументированы. Похоже, что он географически ограничен определенными районами, такими как Папуа, Новая Гвинея. Трофозоиты похожи наE. coli , за исключением немного меньшего размера, а цисты похожи на E. histolytica, за исключением того, что зрелая циста имеет одно ядро.
E. gingivalisможет быть извлечен из мягкого зубного камня между зубами и имеет морфологию, аналогичную histolytica, за исключением того, что у него нет стадии цисты. E. gingivalis также может размножаться в слизи бронхов и, следовательно, появляться в мокроте. В этом случае его можно было спутать с E. histolytica из легочного абсцесса. Трофозоиты E. gingivalis часто содержат проглоченные лейкоциты, которые можно использовать для дифференциации их от E. histolytica . Чаще всего трофозоиты выделяются у пациентов с пародонтозом, но этиология между организмом и заболеванием не установлена, и E. gingivalis считается непатогенным.
Другие кишечные амебы
К другим непатогенным амебам относятся Endolimax nana и Iodoamoeba bötschlii . Исторически Dientamoeba fragilis была сгруппирована с амебой, но электронная микроскопия и молекулярная филогенетика позволяют предположить, что это на самом деле жгутиконосцы и могут быть тесно связаны с трихомонадами (см. Выше). Все три из этих организмов имеют сходную морфологию и имеют ядра, не имеющие периферического хроматина и большой кариосомы. Незначительные морфологические различия позволяют различить эти организмы (таблица).
|
Другие кишечные амебы |
|||||||||||||||
* Жгутиконосец, возможно, относящийся к трихомонадам. |
Другие кишечные жгутики
Четыре дополнительных непатогенных жгутиконосца, выделенных из стула человека, это: Trichomonas hominis , Chilomastix mesnili , Enteromonas hominis и Retortamonas Кишечник . Среди них T. hominis , также называемый Pentatrichomonas hominis , является наиболее распространенным и часто выздоравливает при диарее стула. Эти жгутиконосцы имеют сходную морфологию (таблица), и их бывает трудно различить. Трофозоиты всех этих жгутиконосцев имеют несколько каплевидную форму и содержат одно ядро, а циста имеет тенденцию быть слегка удлиненной или овальной.
|
Другие кишечные жгутики |
||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||
ССЫЛКИ
- НАЧАЛО
- СОДЕРЖАНИЕ
- Лямблиоз
- Трихомониаз
- Балантидоз
- Амебиаз
- Непатогенные комменсалы
- Протозоология Главная
- Другие курсы и лекции
- Домашняя страница Вайзера
- Другие интернет-сайты
_____________________________________________________________________________________________________________
Эти страницы разработаны и поддерживаются Марком Ф. Уайзером, Университет Тулейна (© 2000).
Последнее обновление 13 ноября 2020 года .
Об авторе
Марк Ф. Уайзер,
доктор философии, доцент
Заместитель декана

Образование
Доктор философии, клеточная биология, Миннесотский университет
Бакалавр биологии, Франклин-колледж Индианы
биография
Главный интерес Марка Визера – молекулярная и клеточная биология простейших паразитов и их взаимодействия с хозяевами. Основные достижения в исследованиях включают описание белков, синтезируемых малярийным паразитом и экспортируемых в клетку-хозяин; предложенный новый секреторный путь малярийного паразита, который функционирует для нацеливания белков на эритроциты хозяина, а также характеристика протеинкиназ и шаперонов малярийного паразита. Он также преподает курс медицинской протозоологии и написал учебник ( Простейшие и болезни человека ) по этой теме.
Публикации
Просмотрите публикации доктора Вайзера на его странице профиля в NCBI .
Информация о факультете
Области исследований
- Медицинская протозоология
- Клеточная и молекулярная биология малярии
Курсы
- TRMD 6010 Биологическая основа болезни
- TRMD 6070 Медицинская протозоология
- TRMD 6080 Медицинская лаборатория протозоологии
- TRMD 6090 Паразитологическая лаборатория
- TRMD 7020 Семинар по инфекционным болезням
Честь и Почет
- 2002: Награда ученого-преподавателя Центра медицинских наук Тулейнского университета
- 1999: Премия за выдающиеся достижения в области преподавания